Определение недостатка микроэлементов и установление оптимального уровня – Физиология минерального питания
Определение недостатка микроэлементов и установление оптимального уровня – Физиология минерального питания
Физиология минерального питания
Глава 5. ФИЗИОЛОГИЯ МИНЕРАЛЬНОГО ПИТАНИЯ
Растения могут поглощать и перемещать неорганические и органические вещества. Раньше считали, что для роста растений (фотосинтезирующих автотрофов) необходимы только минеральные элементы. Однако в последние годы показано, что многие водоросли требуют витамины В12, а также веществ, содержащих кобальт и т. д.
Для наземных растений основным источником воды и минеральных веществ служит почва, не менее важна и атмосфера, которая обеспечивает фотосинтезирующие растения СО2, и, в свою очередь, сама атмосфера поглощает О2 и воду, выделяемую при транспирации.
В системе растение-почва-атмосфера происходит значительный круговорот веществ, особенно воды и СО2.
^ 5.1. Минеральные элементы
Концентрация минеральных веществ в самих растениях в большинстве случаев мало связана с их концентрацией в среде. Например, соотношение K + /Na + в растениях обычно составляет 5–20, тогда как в среде, как правило, больше Na + . С другой стороны, элементы, содержащиеся в окружающей среде в низких концентрациях, могут накапливаться в растениях в значительном количестве.
Эта способность растений характеризуется так называемым коэффициентом накопления:

Качественный состав внутриклеточного содержания растений все же зависит от содержания минеральных веществ в почве, а также от условий окружающей среды. Все элементы, которые присутствуют в почве, могут быть выявлены в растениях. Содержание одного и того же элемента в тканях и клетках растений очень неустойчивое и зависит от многих факторов.
Потребность в минеральных элементах у растений весьма разнообразная. Однако можно утверждать, что отсутствие необходимого для роста и размножения элемента вызывает определенные симптомы голодания.
Еще раз отметим, что ни присутствие, ни концентрация минеральных элементов в самих растениях не является критерием необходимости. Хорошо зарекомендовало себя в этом отношении (относительно необходимости) так называемое тройное правило Арнона, которое было предложено еще в 1939 году. Элемент признается необходимым в случае, когда:
1. Растение без него не может закончить свой жизненный цикл;
2. Другой элемент не может заменить функцию изучаемого элемента;
3. Элемент непосредственно включен в метаболизм растения.
Подвижность разных веществ в почве широко варьирует: высокоподвижные – калий, натрий, фосфор, сера; среднеподвижные – магний, железо, медь, цинк; относительно подвижные – кальций, магний, бор.
Однако подвижность ионов промежуточной группы зависит от их количества в почве (увеличивается с увеличением концентрации).
Принципы подбора природой металлов для построения биомассы до настоящего времени не выяснены, хотя точно известно, что их распространение не было решающим критерием. Так алюминий и титан – очень распространены в природе, однако не являются элементами жизни.
Напротив, молибден, редко встречающийся в природе, является очень необходимым, например, при переносе электронов.
^ Макро и микроэлементы. Питательные элементы, которые используются растениями из субстрата в больших количествах (содержание их в золе 10 –1 –10 –2 %), называют макроэлементами, а необходимые в значительно меньшем количестве (содержание 10 –3 % и ниже) – микроэлементами.
Вода и СО2 рассматриваются отдельно, но в этом контексте необходимо считать их макроэлементами. К макроэлементам относятся K, Ca, Mg, N, P, S (Н2О и СО2), для галофитов следует добавить Na и Cl.
Микроэлементы: Mn, Zn, Cu, Cl, B, Mo, сюда же относится и Fe, который располагается на границе макро- и микроэлементов.
Водорослям необходим один или несколько из следующих элементов: Со, Si, I, V. Некоторым высшим растениям необходимы селен, кремний.
Кроме необходимых элементов для роста, в оптимальных пределах должны быть и другие факторы: рН, температура, обеспечение О2, градиент водного потенциала, а для зеленых растений – освещенность соответствующей интенсивности и протяженности.
Минеральные элементы играют определенную роль в обмене веществ в растении. Отметим, что в отсутствии наименее важного из этих элементов жизнь была бы невозможна, как и при излишестве любого из них.
Среди физиологов растений раньше был распространен взгляд в соответствии с которым считали, что элементы минерального питания поступают в растения с водой на основе осмотических и диффузионных ограничений. Однако Д. А. Сабинин показал, что эти процессы независимы:
– нет прямой связи между транспортируемым количеством растением воды и количеством солей, поглощаемых из почвенного раствора корневой системой;
– наблюдаемое одновременное движение ионов и воды через корневые системы происходит в противоположных направлениях;
- механизмы поступления воды и ионов разные.
Физиологические функции минеральных элементов и форма их поступления в клетку приведены в табл. 5.1.
^ Таблица 5.1
Физиологические функции минеральных элементов
Синтез нуклеиновых кислот, АТФ и некоторых белков. Входит в состав фосфолипидов мембран, играет ключевую роль в переносе энергии
^ 5.2. Транспорт минеральных веществ в клетку
Теперь, когда мы рассмотрели функции минеральных элементов, необходимых для нормального роста растений, следует обсудить механизмы их поступления в растения и структурные элементы, по которым предстоит им двигаться. Минеральные вещества обычно поглощаются из почвы с помощью корней. Они могут поступать в небольших количествах также и через листья, поэтому внекорневое внесение некоторых микроэлементов стало стандартным сельскохозяйственным методом. Минеральные вещества почти всегда поступают в растения в форме ионов. Эти ионы сначала должны пересечь оболочку и плазмалемму, с тем, чтобы попасть в цитоплазму: затем при необходимости пройти и через мембрану, окружающую вакуоль (тонопласт) или какую-либо клеточную органеллу, для того, чтобы оказаться в том или ином внутреннем компартменте.
Изучение вопроса транспорта элементов является одним из основных в проблеме минерального питания. Это предопределяется следующими обстоятельствами. Во-первых, суть питания растений состоит в поступлении и включении в метаболизм минеральных элементов в результате обмена между организмом и средой. Во-вторых, изучение процесса транспорта элементов сопряжено с выяснением свойств и функций клеточной оболочки, мембранных образований, связи между клетками и тканями. В-третьих, выяснение вопросов, связанных с транспортом, приближает нас к целенаправленному управлению продуктивностью сельскохозяйственных растений.
^ Гидратированное состояние ионов. Перенос ионов через мембрану связан с определенными трудностями. Одной из трудностей является наличие гидратированной воды, которая окружает ион и значительно увеличивает его объем.
Рассмотрим одновалентные ионы, в частности катионы Li + , Na + , K + , Rb + и Cs + : самое легкое ядро у лития, а самое тяжелое у цезия. С увеличением массового числа растет также и количество электронов, которые окружают ядро и объем пространства, занимаемого электронными орбиталями. Поскольку плотность электронного облака, окружающего ядро мала, можно предположить, что ядро более доступно внешним воздействиям. Эта зависимость находит свое отражение в величинах радиусов гидратированных ионов: Li + – 0,06; Na + – 0,095; K + – 0,133; Rb + – 0,148; Cs + – 169 нм.
В водных растворах молекулы воды удерживаются около ионов электростатическими силами, источником которых служат заряженные частицы атомного ядра. Чем ближе могут подойти к заряженному атомному ядру молекулы воды, тем сильнее они связываются и тем больше изменяется величина свободной энергии, обусловленная гидратацией. Таким образом, у лития молекулы воды ближе к ядру и это значит, что в гидратной оболочке лития содержится больше молекул воды. Известно, что молекулы воды являются диполями. Около катионов все ближайшие молекулы воды ориентируются отрицательными полюсами внутрь, а около анионов внутрь направлены положительные полюсы молекул воды (рис. 5.1).

о
н






















Рис. 5.1. Ориентация молекул воды вокруг катиона и аниона
Этот внутренний, сильно связанный с ионами структурированный слой молекул воды, называют первичной оболочкой.
На некотором отдалении, превышающем толщину первичной оболочки, напряженность электрического поля несколько снижается, что приводит к изменению нормальной ориентации молекул воды. Из-за этого вокруг иона возникает вторичная оболочка (рис. 5.2).

Таким образом, благодаря гидратной оболочке размеры ионов сильно увеличиваются. Между радиусами гидратированных и негидратированных катионов щелочных металлов существует обратная зависимость, т. е. гидратированный ион, имеющий меньший кристаллический радиус, имеет большие размеры. Радиусы гидратированных ионов трудно вычислить; данные разных авторов значительно разнятся. Подвижность ионов дает представление об их относительных размерах (табл. 5.2).
Определение недостатка микроэлементов и установление оптимального уровня – Физиология минерального питания
История изучения минерального питания растений. Круг проблем, составляющих раздел физиологии растений “минеральное питание”; их взаимосвязь с практикой с/х производства, биохимией, биофизикой, генетикой, экологией, медициной. Д.А.Сабинин и развитие представлений о физиологии минерального питания растений.
Круговорот элементов минерального питания в биосфере; роль растений. Автотрофность растений в отношении использования минеральных элементов. Вегетационный метод – инструмент изучения минерального питания. Концентрирование в тканях элементов минерального питания. Необходимые растениям макро- и микроэлементы. Определение понятий “необходимые” и “полезные” растению элементы. Вариабельность в потребности и накоплении минеральных элементов у видов растений и в зависимости от условий.
Корни и почва, как система, обеспечивающая растения элементами минерального питания.
Состав и структура почвы. Запасы элементов минерального питания в почве и их доступность (адсорбированные ионы, почвенный раствор, труднорастворимые соединения). Действие рН на доступность минеральных элементов почвы; значения рН, оптимальные для роста разных видов растений. Корни, как высокоспециализированная система поглощения минеральных элементов и воды, дальнего транспорта веществ, усвоения минеральных элементов, закрепления растений в почве. Распространение корней в почве и рост, как процесс, обеспечивающий поглощение минеральных элементов. Ионы, как сигналы, запускающие программу роста и изменение морфологии корней. Морфология и анатомия корня – структурная основа для выполнения различных функций. Зоны роста корня. Представления о значении зон корня в поглощении ионов и их перемещении в другие части растения. Вклад Д.А. Сабинина. Роль микоризы в процессе поглощения веществ корнями. Формирование системы “корень и среда” ; взаимодействие её компонентов в пространстве и во времени.
Поглощение ионов из среды и передвижение минеральных элементов по растению.
Понятие поглощение и общая характеристика процессов транспорта в системе целого растения. Апопласт и симпласт: их структурная основа, роль в поступлении минеральных веществ и интеграции поглощения с другими физиологическими процессами.
Поступление ионов в апопласт. Строение клеточной стенки; её физико-химические характеристики. Понятие свободного пространства (СП), оценка его размеров. Механизмы поступления ионов в СП; значение этого этапа для последующего транспорта ионов в симпласт.
Транспорт ионов через клеточные мембраны (плазмалемму и тонопласт). Строение мембраны; её особенности, обеспечивающие избирательность в поглощении и накоплении ионов клеткой. Пассивный и активный перенос ионов через мембраны. Критерии активного транспорта. Уравнение Нернста. Движущие силы переноса ионов через мембрану. Мембранный электрический потенциал; его образование и поддержание. Хемиосмотическая теория Митчелла и развитие представлений о механизмах транспорта. Протонные помпы плазмалеммы и тонопласта: Н + -АТФазы , пирофосфатазы, редокс-цепи. Непротонные растительные АТФазы; их функции. Вторичный активный транспорт на плазмалемме и тонопласте. Кинетический подход и теория переносчиков. Зависимость скорости поглощения иона от его концентрации в среде. Использование Vmax и Km уравнения Михаэлиса-Ментен для характеристики транспортных систем. Пассивный транспорт. Ионные каналы растений. Общая модель структуры, функционирования и регуляции ионного канала. Методы изучения транспортных систем растений. Молекулярно-генетические исследования переносчиков ионов и механизмов транспорта. Идентифицированные и постулированные транспортные системы плазменной и вакуолярной мембраны растительной клетки. Особенности систем транспорта через эндомембраны клеточных структур.
Поступление ионов в корень. Понятие о потоке ионов. Поглощение, как результат двух потоков: входа (инфлакса) иона из среды в корень и выхода (эффлакса) из корня наружу. Трехкомпартментная, одноклеточная модель корня. Роль “вакуолярной емкости” в поглощении. Трехклеточная модель поступления ионов в корень и их перемещения в ксилему.
Радиальный транспорт веществ в корне. Апопластный путь: роль эндодермы, специфика передвижения отдельных ионов; взаимосвязь с транспортом воды. Перемещение ионов по симпласту. Плазмодесмы: строение, распределение и значение для транспорта. Схема участия тканей корня в радиальном транспорте. Роль эндоплазматического ретикулума в симпластном радиальном транспорте ионов. Механизмы загрузки ксилемы. Взаимодействие и регуляция систем поступления ионов в корень и загрузки ксилемы.
Дальний транспорт минеральных элементов. Состав веществ ксилемного сока. Метод сбора и анализа пасоки. Перемещение элементов минерального питания по флоэме. Регуляция поглощения ионов корнями; адаптивные изменения систем транспорта в зависимости от доступности элементов в среде и других внешних и внутренних факторов. Контроль поступления ионов через “запрос” надземных органов. Генетическая детерминированность процессов поглощения. Поиск и селекционный отбор форм с эффективными системами поглощения и использования элементов минерального питания.
Биологическая роль элементов минерального питания.
Классификация элементов минерального питания, основанная на их функциональной роли.
Калий. Содержание и распределение калия по органам растений; его циркуляция и реутилизация. Характеристика систем транспорта К + , их функции в растении. Роль К + в поддержании потенциала на мембранах. Функции калия, связанные с поддержанием гомеостаза внутриклеточной и тканевой среды (катионно/анионный баланс, рН, осморегуляция, гидратация и конформация клеточных структур). Механизм устьичных движений. Калий, как активатор ферментных систем.
Кальций. Накопление, формы соединений, особенности поступления и перемещения Са 2+ по растению, возможность его реутилизации. Концентрация и распределение Са 2+ в структурах клетки. Функции кальция в апопласте и вакуоли. Роль Са 2+ в регуляции клеточных процессов и формировании ответных реакций на внешние и внутренние воздействия. Характеристика мембранных систем транспорта Са 2+ , особенности их регуляции и роль в формировании Са 2+ -сигнала. Общая схема путей передачи сигнала на мишени, в клетке, в связи с ответной реакцией на различные стимулы. Специфичность кодирования и передачи Са 2+ -сигнала в зависимости от природы и характера стимула. Посредничество Са 2+ в управлении комплексными физиологическими процессами: устьичные движения; рост кончиком (пыльцевая трубка и корневой волосок); гравиотропизм; фототропизм; фотоморфогенез; адаптация к стрессу и др.
Магний. Содержание и соединения магния в тканях растений. Значение связи Mg 2+ с аденозинфосфатами и фосфорилированными сахарами. Роль в поддержании рН-стата и дальнем транспорте веществ. Запасные формы Mg 2+ , его реутилизация и перераспределение в растении. Функции магния в фотосинтезе. Магний – как активатор ферментных систем; роль в образовании функциональных рибосом.
Азот. Смотри программу спецкурса  “Азотный обмен растений”.
“Азотный обмен растений”.
Фосфор. Доступность фосфора в почве, особенности транспорта в корни и зависимость поглощения Pi от условий среды. Формы Р-соединений (органические и неорганические) и их распределение в клеточных структурах, тканях и органах. Запасание фосфора. Особенности транспорта соединений фосфора. Метаболическая компартментация его соединений в клетке. Функции роль фосфора в запасании и превращении энергии, структурной организации мембран, кодировании и реализации наследственной информации, обмене углеводов. Фосфор и метаболитная регуляция процессов. 1,4,5-фосфоинозитол, как вторичный мессенжер. Контроль ферментной активности через обратимое фосфорилирование белков.
Сера. Цикл серы в природе, соединения, используемые растением. Пути восстановления серы в растении, связь с фотосинтезом. Соединения серы в тканях. Значение сульфидной и дисульфидной связи; серосодержащие ферменты. Роль серы в энергетическом обмене. Значение глутатиона и фитохелатинов.
Микроэлементы.
Железо: доступность в почве, валентность поглощаемой формы, роль микоризы. Особенности поступления железа у двудольных и однодольных растений. Соединения железа; распределение по компартментам клетки и в растении. Комплексы железа в белках редокс-цепей и других ферментах. Железо и синтез хлорофилла. Медь: Содержание и распределение в клетке и тканях. Участие в окислительно-восстановительных процессах дыхания и фотосинтеза. Функции цитозольных оксидаз (аскорбат-, фенол- и диаминоксидаз).
Марганец: Активируемые им ферментные системы, его специфичность, как кофактора. Роль Mn 2+ в функционировании ФС-2.
Молибден: Потребность в элементе; его значение для процессов утилизации азота среды. Мо-птерин и функционирование нитрогеназы и нитратредуктазы.
Цинк: Его структурная роль в поддержании ферментной активности и при синтезе белка. Метаболические функции ферментов, содержащих цинк.
Микроэлементы и изоформы супероксиддисмутазы, их локализация в клетке и роль в защите тканей от активных форм кислорода.
Бор: компартментация в клетке; формы соединений. Механизмы участия в регуляции физиологических процессов и метаболизма.
Нарушения в метаболизме растений при недостатке микроэлементов. Токсичность тяжелых металлов для растений их накопление в тканях. Механизмы защиты. Видоспецифичность в чувствительности и устойчивости растений к избытку и недостатку тяжелых металлов в среде. Фиторемедиация.
Регуляция процессов поступления, накопления и распределения элементов минерального питания в системе целого растения
Взаимоотношение ионов при их поглощении. Поступление, накопление и распределение по органам элементов питания в зависимости от внешних и внутренних факторов (доступность, рН, температура, водообеспеченность, видоспецифичность, возраст и др.). Баланс катионов и анионов в тканях. Поддержание рН-стата растения. Осморегуляция в растительных тканях. Роль компартментации в регуляции транспорта, накопления и обмена ионов. Связь процессов минерального питания с водообменом, дыханием и фотосинтезом; их интеграция и взаиморегуляция на уровне клетки, органа и целого растения. Донорно-акцепторные отношения, реутилизация и круговорот минеральных элементов в растении. Минеральное питание, рост и продуктивность растений. Использование показателей обмена минеральных элементов для оценки хозяйственно полезных качеств (эффективность использования удобрений, соле- и засухоустойчивость, качество с/х продукции и т.д.). Минеральное питание и моделирование продукционного процесса.
Литература:
- Медведев С.С. Электрофизиология растений. С.-Петербург, Изд-во С.-Петербургского Ун-та, 1998. 182 с.
- Вахмистров Д.Б. Пространственная организация ионного транспорта в корне. 49 Тимирязевские чтения. М.: Наука, 1991. 49 с.
- Маркарова Е.Н. Физиология корневого питания растений. М.: Изд-во МГУ, 1989. 103 с.
- Кабата-Пендиас З.А., Пендиас С. Микроэлементы в почвах и растениях. М.: Мир, 1989. 439 c.
- Люттге У., Хигинботам Н. Передвижение веществ в растениях. М.: Колос, 1984. 408 с.
Физиология минерального питания – Причины изменений содержания микроэлементов в растении винограда
Содержание материала
Кроме причин, связанных с почвенными условиями (характер материнской породы, педогенетические процессы, физические свойства почвы, pH и др.) и агротехникой (регулирование содержания извести, органическое и минеральное удобрения, обработка ядохимикатами, орошение и др.), существуют генетико-биологические и сезонные факторы, вызывающие изменения содержания микроэлементов в растении в целом и в отдельных его органах — селективность подвоев, сортовые различия и факторы окружающей среды.
Уровень микроэлементов в различных органах растения винограда
Железо.
Данные о содержании железа многочисленны, так как его частая нехватка становится причиной тяжелых проявлений хлороза. В связи с этим Sаrоsi (1964, 1975) считает, что уровень железа в листьях ниже 100 ppm; является показателем его недостатка и предлагает в качестве оптимальных величин 110—160 ppm (осенью). Christensen (1969) устанавливает, однако, в черешках листьев кустов без симптомов недостатка уровень 80 ppm при образовании завязей и 53 ppm в начале созревания. По данным L a f о η с сотр. (1964) в листьях при образовании завязей содержание железа составляет 39 ppm, в начале созревания — 170 ppm и при созревании — 203 ppm; Beyers (1962) в Южной Африке устанавливает в листьях предельные уровни 60 и 180 ppm.
В Италии Fregoni и Scienza обнаруживают в результате пятилетних исследований, что уровень железа в листьях (пластинках) варьирует от 173 до 500 ppm. При образовании завязей содержание железа обычно несколько ниже (131—436 ppm), чем в начале созревания (216—564 ppm). Rоssi (1975) определяет в области Эмилия-Романья среднее содержание железа 132—198 ppm. Значительно более низкий уровень (47—97 ppm) наблюдают Jung, Im (1972) в Корее, но наряду с очень высоким уровнем марганца, считающимся токсическим (824—2596 ppm). Кiri1уuk (1976) отмечает, что, как правило, в листьях содержится больше микроэлементов, чем в побегах, сусле и вине. В частности, он наблюдает накопление железа в листьях в ходе созревания и снижение количества бора и марганца. Содержание железа в листьях составляет примерно 302—3220 pmm.
Далее отмечается, что содержание железа повышено в листьях, находящихся у основания побегов, по сравнению с находящимися в верхней зоне и понижено в черешках по сравнению с пластинками, так как оно малоподвижно. Действительно, данные Carles с сотр. (1964) показывают, что в пластинках листьев содержится между 206 и 306 ppm железа, тогда как содержание его в черешках составляет 57—60 p pm при соотношении пластинка: черешок 3,6:5,1. В гроздях содержание железа колеблется в пределах от 45 до 58 ppm (Fregoni, Scienza, 1975а), в то время как только в ягодах оно составляет 60—78 ppm.
Молодые побеги содержат 60—70 ppm железа, тогда как вызревшие — 111—161 ppm. Содержание железа в конусе нарастания выше (103—122 ppm), чем в остальной части побега (Fregoni, Scienza, 1976). Корни довольно богаты железом — от 194 до 199 ppm (Fregoni, Scienza, 1974а) в противоположность семенам, оказавшимся наиболее бедными этим элементом— 43—47 ppm (Fregoni, Scienza, 1976 а). В соке Dogramadjian (1975) установил уровень железа 2—5 ppm.
Тесно связан с содержанием железа уровень марганца, так как эти два элемента находятся в антагонистических отношениях.
Этот антагонизм выражается в значениях соотношения железо: марганец. В кустах, выращенных на питательном растворе, это соотношение колеблется от 0,99 до 0,48 в зависимости от наличия или отсутствия железа в среде. Считается, что железный хлороз проявляется при значениях этого соотношения ниже 1. Delmas (1975) считает оптимальным для гидропонной культуры винограда соотношение 1 во время цветения и 0,6 в начале созревания. Когда это соотношение превысит 5, возникает нехватка марганца. В итоге пятилетних исследований Fregoni и Scienfa в Италии установили нормальное значение соотношения железо: марганец в листьях 2,25:2,46 (табл. 2). Dogramadjian (1975) считает, что соотношение железа и марганца в пасоке имеет значительную диагностическую ценность в отношении установления морозостойкости некоторых сортов. Действительно, у морозостойких сортов это соотношение составляет 0,15, тогда как у неморозостойких оно колеблется в пределах 0,1—0,6.
Таблица 2
Содержание микроэлементов (ррт) в листьях при образовании завязей (А) и и начале созревания (I) на нескольких виноградниках Италии, определенное техникой листовой диагностики (1974—1976) 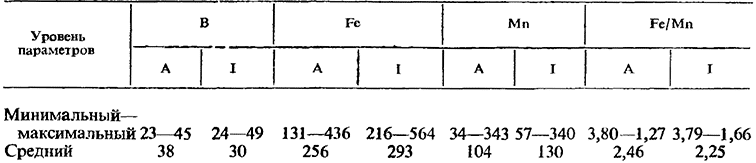
Sаrоsi (1975) считает оптимальным содержание бора 30—50 ppm в 8-м листе осенью. Christensen (1969) при помощи техники листовой диагностики определяет в черешках листьев 40 ррm при образовании завязей и в начале созревания. Аналогично этому Sarosi на основании имеющейся в их распоряжении обширной информации считает нормальным для условий Италии содержание бора в листьях от 25 до 41 ppm (23—47 ppm при образовании завязей и 24—49 ppm в начале созревания) (табл. 2). Levy (1968) считает, что 25—40 ppm — нормальное содержание. Gartel (1956, 1974) считает оптимальным содержанием бора в листьях 15—38 ppm, в то время как недостаток его проявляется на уровне ниже 9—10 ppm. Кiri1уuк (1976) устанавливает в листьях в зависимости от сорта значительно более высокое содержание — 141—298 ppm. По мнению Lafоn с сотр. (1964) нормальный уровень бора в листьях колеблется от 20 до 23 ppm соответственно при образовании завязей и в начале созревания, в то время как в побегах в это же время он составляет 20—14 ppm, а в гроздях — 25—28 ppm. Fregoni и Sciеnzа (1974а) устанавливают уровень бора в побегах 31—44 ppm, в вызревших побегах — 42—57 ppm и в корнях — 48—68 ppm. Особенно высоким является содержание этого элемента в семенах — 75—85 ppm (Fregoni, Sсiеnzа, 1976a).
Cartel (1974) утверждает, что определение содержания бора в сусле является отличным способом установления потребности виноградной лозы в подкормке бором. Оно должно составлять 2—5 ppm в нормальных случаях, недостаток же наступает при уровне ниже 1—1,5 ppm.
Значение бора для оплодотворения подтверждается высоким уровнем этого микроэлемента в органах цветка. Gаrtе1 (1962а) устанавливает в рыльце 50—60 ppm, в то время как в секрете рыльца в ранние утренние часы содержится 2—5 ppm (40—140 ppm в сухом веществе). При падении уровня бора до 8—10 ppm оплодотворение понижается. В пасоке по Dogramadjian (1975) содержится в зависимости от сорта 0,032—0,75 ppm бора.
Большое значение имеет токсичность в результате чрезмерного внесения борных удобрений. Вредным считается содержание бора в пластинках листьев в количестве 700—1000 ppm и в черенках — 100—300 ppm (Gаrtе1, 1974). Levy, и Chaler (1964) считают все же, что уже уровень бора в листьях выше 60 ppm является токсичным. Beyers (1962) считает нормальным уровень бора в листьях 25—100 ppm и токсичным — выше 400 ppm.
Марганец.
Явления недостаточности этого элемента не имеют существенного значения, более важные проявления его токсичности в почвах с низкими значениями pH и богатых марганцовыми солями. Badour и Levy (1964) считают нормальным содержание марганца в листьях 30—80 ppm, тогда как недостаток отмечается на уровне 5—25 ppm. Sаrоsi (1975) считает оптимальным содержание марганца в листьях осенью 57—130 ppm. Christensen (1969) устанавливает в черешках листьев со стороны, супротивной грозди, уровень марганца 56 ppm при образовании завязей и 54 ppm — в начале созревания. Нормальное содержание марганца в листьях в области Эмилия составляет 80—112 ppm (Rоssi, 1975). Beyer (1962) определяет в Южной Африке от 20 до 300 ppm марганца в листьях. Токсичный уровень — 1000 ppm.
Листья являются наиболее богатыми марганцем органами растения винограда (2/5 всего количества этого элемента содержатся в листьях). Нормальный уровень, по мнению Gartel, составляет 30—60 ppm. Исследованиями Fregoni и Scienza установлено, что содержание марганца в листьях винограда в условиях Италии колеблется примерно от 104 ppm при образовании завязей до 130 ppm в начале созревания с максимумом 600 ppm (табл. 2). Несмотря на столь высокий уровень, он никогда не вызывал явных симптомов токсичности, быть может потому, что сопровождался столь же высоким содержанием железа. Кiri1уuк (1976) установил в листьях сортов Рислинг и Каберне Совиньон содержание марганца 114—190 ppm. Carles с сотр. (1964) установили, что содержание марганца в пластинках листьев выше (40—70 ppm), чем в черешках (16—32 ppm), при соотношении пластинка: черешок 2,2 :2,5. Это позволяет утверждать, что черешок контролирует переход марганца в пластинку листа. К полностью противоположным выводам пришел Sаrоsi (1975), считающий повышенное содержание марганца в черешках листьев показателем его значительной подвижности в растении. Бедны марганцем древесина вызревших побегов (10—15 ppm) и семена (7—10 ppm), тогда как в сусле его содержание 0,4—1,4 mg/1 (Sabatelli с сотр., 1972; Gartel, 1974). В вине Чинкуе терре содержится до 3,4 ppm. Lafоn с сотр. (1964) установили в листьях 17—19 ppm соответственно при образовании завязей и в начале созревания, 6—7 ppm в молодых побегах и 5—15 ppm в гроздях. На повышенные значения указывают аналитические результаты Frеgonin Scienza (1974а, 1976): в ягодах — около 5—6 ppm, в конусе нарастания — 17—24 ppm, в семенах — 10—12 ppm, в побегах — 27—32 ppm и в корнях — 26—31 ppm. Sabatelli с сотр. (1972) установили для сорта Кьянти величины в среднем 19 ppm в гребнях гроздей, 6 ppm — в кожице ягод, 0,4 ppm — в мякоти и 19 ppm — в семенах.
Различия нередко объясняются принятыми аналитическими методами. По мнению Ribereau-Gayon и Peynaud (1960) существует избирательная концентрация в различных частях ягоды в соотношении семена: кожица:мякоть — 30:10:1. По данным Dogramadjian (1975) в пасоке содержится в среднем 0,32—1,87 ppm. Что же касается токсичности, Vidal с сотр. (1969) установили симптомы заболевания при содержании марганца в листьях от 221 до 3000 ppm. Gаrtе1 (1974) считает токсическим уровень марганца в листьях от 1200—1800 ppm до 5000 ppm. Такой уровень считают токсическим также Badour и Levy (1964). Вranas (1974) установил проявления токсичности при уровне марганца в листьях 45—230 ppm в зависимости от расположения побега.
Цинковая недостаточность винограда в Европе — явление редкое и возникает лишь в случаях внесения высоких доз фосфора (Gаrtе1, 1974). Уровень 25—60 ppm в листьях считается нормальным, 2—16 ppm — недостаточным (Gаrtе1, 1974). Christensen и Kasimatis (1967) установили в черешках листьев содержание цинка 10—17 ppm в мае и 22—27 ppm в июле. Christensen (1969) считает нормальным уровнем цинка в черешках 30 ppm при образовании завязей и 34 ppm в начале созревания. Sаrоsi (1975) считает содержание 20—22 ppm в восьмом листе достаточным, уровень 15 ppm уже указывает на латентную недостаточность. Frеgоni и Sсiеnzа (1974а) установили в здоровых кустах с интоксикацией медью уровень цинка в листьях 87—120 ppm, в побегах — 48—51 ppm, в вызревших побегах — 39—71 ppm и в корнях — 38—59 ppm. По данным Gаrtе1 (1974) наиболее высоко содержание цинка в меристематических тканях; богаче всего листья (в них содержится около 30—40% всего количества цинка в растении), молодые побеги и почки. Древесина побегов наиболее бедна цинком. В сусле содержится около 3—5 ppm (Gаrtе1, 1955).
Недостатка меди практически не бывает, однако считается, что ее нормальный уровень в листьях колеблется от 4-8 (Sаrоsi, 1975) до 40— 50 ppm (Carles с сотр., 1966). Значительно большее содержание меди установлено в листьях—185—424 ppm (Кri1уuк, 1976). Одревесневшие побеги и ягоды — самые бедные медью части лозы. Молодые побеги содержат 17— 26 ppm меди, а грозди и побеги — 21—27 ppm (Саr1еs с сотр., 1966; Frеni, Scienza, 1974). Нередко обнаруживается интоксикация в результате накопления меди в почве, причем наиболее чувствительны корни. Gаrtеl (1974) установил уровень меди 178 ppm в корнях в почве, обогащенной медью, против 6 ppm в корнях в нормальной почве. Fregoni и Scienzа (1974) в условиях интоксикации медью установили в корнях растений содержание меди 100 ppm, тогда как в корнях нормальных кустов ее содержание не превышало 48 ppm. В сусле содержалось около 0,2—4 mg/l меди. Если, однако, кусты обрабатывались содержащими медь препаратами, ее содержание в сусле возрастало до 6—25 mg/l (Gаrtе1, 1974).
Ценным диагностическим методом, кроме анализа корней, оказалось определение активности пероксидазы и полифенолоксидазы в вытяжках листьев. При наличии симптомов токсичности активность этих энзимов понижается до 50% и возрастает в 6 раз. Изменяется также содержание хлорофилла — общего, „а“ и „б“, но в первую очередь варьирует соответственное соотношение (Fregoni, Scienza, 1974).
Молибден.
Симптомы недостаточности этого элемента установлены только у растений, выращивавшихся на питательных растворах, и никогда — на виноградниках, Из проведенных Gаrtе1 исследований (1974) явствует, что наиболее богата молибденом пыльца (около 1 ppm), тогда как в листьях его содержится около 0,2 ppm.
Древесина наиболее бедна молибденом — 0,1 ppm. Сусло содержит от 0,0047 до 0,169 mg/l молибдена, вино — от 0,0011 до 112 mg/l. Delmas (1975) установил, что недостаток молибдена вызывает обогащение листьев марганцем и кальцием и обеднение калием.
Сезонные колебания основных микроэлементов в различных органах растения винограда
Железо.
В листьях молодых побегов и в ходе вегетации динамика содержания этого элемента неравномерна. Наиболее высок его уровень в начале созревания в черешках листьев, находящихся у основания побега (Christensen, 1969; Sаrоsi, 1975). Fregoni и Scienza установили, что в ягодах оно возрастает до начала созревания и затем по мере созревания прогрессивно снижается (рис. 2). Аналогичное развитие наблюдается при выражении содержания железа в mg/l000 ягод; т. е. кривая роста имеет форму двойного сигмоида. Lafon с сотр. (1964) констатировали, что ритм поглощения этого элемента достигает максимума в листьях и молодых побегах в фазе после начала созревания, тогда как в гроздях непрерывно возрастает до сбора урожая.
Величина этого микроэлемента в черешках листьев на протяжении побега и во время вегетации довольно постоянна (Christensen, 1969). Исследования Lafon с сотр. (1964) показывают, что поглощение бора молодыми побегами и листьями возрастает до начала созревания, затем понижается. В гроздях содержание бора такое же, как и железа. Fregoni и Scienza отмечают максимальное содержание этого элемента в ягодах в начале созревания (рис. 2). В пересчете на сухое вещество на 1000 ягод содержание бора возрастает до начала созревания и задерживается на постоянном уровне до сбора урожая.
Марганец.
Содержание марганца в черешках листьев возрастает по мере созревания, независимо от расположения листьев на побеге (Christensen, 1969). Что же касается ритма поглощения, наблюдается постоянный рост (в листьях, побегах и гроздях) до созревания (Lafon с сотр., 1964). В ягодах содержание марганца достигает максимального уровня к началу созревания (в ppm или в сухом веществе на 1000 ягод) (Fregoni, Scienza) (рис. 3).
Источники:
http://userdocs.ru/geografiya/35582/index.html
http://plantphys.bio.msu.ru/especial/mineral.html
http://vinograd.info/knigi/fiziologiya-vinograda-stoev/fiziologiya-mineralnogo-pitaniya-15.html






