Влияние эндогенного ритма на превращение углеводов – Стеблевые части
Влияние эндогенного ритма на превращение углеводов – Стеблевые части
Превращение углеводов при производстве пищевых продуктов
Основные превращения углеводов при производстве пищевых продуктов: гидролиз углеводов под действием кислот и ферментов; дегидратация и термическая деградация углеводов; реакции образования коричневых продуктов (карамелизация и меланоидинообразование); окисление в альдоновые, дикарбоновые и уроновые кислоты под действием окислителей и ферментов; брожение (спиртовое, молочнокислое и другие).
Гидролиз углеводов. Во многих пищевых производствах имеет место гидролиз пищевых гликозидов, олигосахаридов и полисахаридов. Гидролиз зависит от многих факторов: рН, температуры, аномерной конфигурации, комплекса ферментов. Он важен не только для процессов получения пищевых продуктов, но также и для процессов их хранения. В последнем случае реакции гидролиза могут приводить к нежелательным изменениям цвета или, в случае полисахаридов, могут приводить к неспособности их образовывать гели.
Большое внимание сейчас уделяется получению различных зерновых сахарных сиропов из дешевого крахмалсодержащего сырья и крахмала (рожь, кукуруза, сорго и др.). Их получение сводится к использованию разных комбинаций амилолитических ферментных препаратов (a-амилазы, глюкоамилазы, b-амилазы). Возможности ферментативного способа получения разных сахаристых продуктов позволяют получать глюкозофруктозные и высокофруктозные сиропы, применение которых позволяет заменять во многих производствах сахарозу.
Гидролиз крахмала.1. При гидролизе крахмала под действием кислот сначала имеет место ослабление и разрыв ассоциативных связей между макромолекулами амилозы и амилопектина. Это сопровождается нарушением структуры крахмальных зерен и образованием гомогенной массы. Далее идет разрыв a-D-(l,4)- и a-D-( 1,6)-связей с присоединением по месту разрыва молекулы воды. В процессе гидролиза нарастает число свободных альдегидных групп, уменьшается степень полимеризации. По мере гидролиза и нарастания редуцирующих (восстанавливающих) веществ содержание декстринов уменьшается, глюкозы — увеличивается, концентрация мальтозы, три- и тетрасахаров сначала увеличивается, затем их количество снижается. Конечным продуктом гидролиза является глюкоза. На промежуточных стадиях образуются декстрины, три- и тетрасахара, мальтоза. Определенному значению глюкозного эквивалента соответствует определенное соотношение этих продуктов, и, варьируя длительностью гидролиза и условиями его проведения, можно получать различные соотношения отдельных продуктов гидролиза при той или иной величине глюкозного эквивалента.
Кислотный гидролиз долгое время был главным при получении глюкозы из крахмала. Этот способ имеет ряд существенных недостатков, которые связаны с использованием высоких концентраций кислот и высокой температуры, что приводит к образованию продуктов термической деградации и дегидратации углеводов и реакции трансгликозилирования.
2. Крахмал гидролизуется также и под действием амилолитических ферментов. К группе амилолитических ферментов относятся a- и b-амилаза, глюкоамилаза, пуллуланаза и некоторые другие ферменты. Амилазы бывают двух типов: эндо- и экзоамилазы.
Четко выраженной эндоамилазой является a-амилаза, способная к разрыву внутримолекулярных связей в высокополимерных цепях субстрата. Глюкоамилаза и b-амилаза являются экзоамилазами, т. е. ферментами, атакующими субстрат с нередуцирующего конца.
a-Амилаза, действуя на целое крахмальное зерно, атакует его, разрыхляя поверхность и образуя каналы и бороздки, то есть как бы раскалывает зерно на части. Клейстеризованный крахмал гидролизуется ею с образованием не окрашиваемых иодом продуктов — в основном низкомолекулярных декстринов. Процесс гидролиза крахмала многостадийный. В результате воздействия a-амилазы на первых стадиях процесса в гидролизате накапливаются декстрины, затем появляются неокрашиваемые иодом тетра- и тримальтоза, которые очень медленно гидролизуются a-амилазой до ди- и моносахаридов.
Схему гидролиза крахмала (гликогена) a -амилазой можно представить так:
крахмал —————> a-декстрины + мальтоза + глюкоза
(много) (мало) (мало)
b-Амилаза (a-1,4-глюканмальтогидролаза) является экзоамилазой, проявляющей сродство к предпоследней a- (1,4)-связи с нередуцирующего конца линейного участка амилозы или амилопектина. В отличие от a-амилазы, b-амилаза практически не гидролизует нативный крахмал; клейстеризованный крахмал гидролизуется до мальтозы в b-конфигурации.
Схему гидролиза можно записать следующим образом:
крахмал —————> мальтоза + b-декстрины
(гликоген) (54-58%) (42-46%)
Ферментативный гидролиз крахмала присутствует во многих пищевых технологиях, как один из необходимых процессов, обеспечивающих качество конечного продукта — в хлебопечении ( приготовление теста и выпечка хлеба), производстве пива (получение пивного сусла, сушка солода), кваса (получение квасных хлебцев), спирта (подготовка сырья для брожения), различных сахаристых крахмалопродуктов (глюкозы, патоки, сахарных сиропов).
Гидролиз сахарозы.Поскольку сахароза как сырье используется во многих пищевых производствах, необходимо учитывать ее исключительную способность к гидролизу. Это может иметь место при нагревании в присутствии небольшого количества пищевых кислот. Образующиеся при этом редуцирующие сахара (глюкоза, фруктоза) могут участвовать в реакциях дегидратации, карамелизации и меланоидинообразования, образуя окрашенные и ароматические вещества. В ряде случаев это может быть нежелательно.
Ферментативный гидролиз сахарозы под действием фермента b-фрукто-фуранозидазы (сахаразы, инвертазы) играет положительную роль в ряде пищевых технологий. При действии b-фруктофуранозидазы на сахарозу образуются глюкоза и фруктоза. Благодаря этому, в кондитерских изделиях (в частности, в помадных конфетах) добавление b-фруктофуранозидазы предупреждает черствение конфет, в хлебопекарных изделиях — способствует улучшению аромата. Инверсия сахарозы под действием b-фруктофуранозидазы имеет место на начальной стадии производства виноградных вин. Инвертные сиропы, полученные действием b-фруктофуранозидазы на сахарозу, используются при производстве безалкогольных напитков.
Ферментативный гидролиз некрахмалистых полисахаридов.Он имеет место под действием ферментов целлюлолитического, гемицеллюлазного и пектолитического комплекса. Используется в пищевой технологии для более полной переработки сырья и улучшения качества продукции. Например, гидролиз некрахмалистых полисахаридов (пентозанов и др.) при солодоращении имеет значение в последующем для образования окрашенных и ароматических продуктов (при сушке солода и создании определенных органолептических свойств пива). В производстве соков и в виноделии — для осветления, увеличения выхода сока, улучшения условий фильтрации.
Гидролиз целлюлозы происходит под действием комплекса целлюло-литических ферментов.
По современным представлениям гидролиз целлюлозы под действием ферментов целлюлолитического комплекса можно представить следующим образом:
целлюлоза —————> целлоолитосахариды —————> целлобиоза




Гемицеллюлозы вместе с пектиновыми веществами образуют основное вещество клеточных оболочек растений. Гидролиз гемицеллюлоз имеет место под действием обширного комплекса гемицеллюлазных ферментов. Эта группа полисахаридов, разнородная по строению, молекулярной массе и составу, при гидролизе дает разнообразный набор соединений: глюкозу, фруктозу, маннозу, галактозу, ксилозу, арабинозу, глюкуроновую и галактуроновую кислоты.
Гидролиз пектиновых веществ происходит под действием пектолитических ферментов. Пектинэстераза гидролизует сложные эфирные связи в пектиновой кислоте и пектине и отщепляет метиловый спирт. Полигалактуроназа осуществляет гидролитическое расщепление a-1,4-гликозидных связей в цепи пектиновых веществ и по своему действию на пектиновые вещества разделяется на эндо- и экзоферменты.
Протопектиназа — это фермент, действующий на протопектин. Однако вопрос о существовании протопектиназы до последнего времени остается спорным, хотя нельзя отрицать, что при воздействии комплекса пектолитических ферментов на срединные пластинки растительной ткани резко снижается вязкость раствора, уменьшается молекулярная масса пектина без нарастания отщепленных редуцирующих групп.
К основным функциям углеводов в пищевых продуктах относят гидрофильность, связывание ароматических веществ, образование продуктов неферментативного потемнения и пищевого аромата, сладость, структурообразование.
Вопросы для самоконтроля
1. Какие органические вещества относят к классу углеводов?
2. Классификация и основные свойства углеводов.
3. Особенности физиологического значения усваиваемых углеводов. Источники углеводов в питании.
4. Что такое крахмал?
5. Что такое гликоген?
6. Что такое пектиновые вещества?
7. Влияние неусваиваемых углеводов (пищевых волокон) на жизнедеятельность организма человека.
8. Нормы физиологической потребности в усваиваемых и неусваиваемых углеводах.
9. Превращение углеводов при хранении и технологической обработке сырья и пищевых продуктов.
10. Какие функции углеводов в пищевых продуктах Вы знаете?
77.243.189.108 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Аэробная стадия превращений углеводов
При адекватном снабжении тканей кислородом НАД-Н2 передает отщепленные в реакциях превращения фосфоглицеринового альдегида два атома водорода (два протона и два электрона) в дыхательную цепь, в конце которой они соединяются с кислородом с образованием воды. Процесс переноса водорода по дыхательной цепи сопровождается освобождением энергии, за счет которой ресинтезируется три молекулы АТФ. При неадекватном снабжении тканей кислородом по аэробному пути расщепляется только часть углеводов.
В ходе аэробных превращений пировиноградная кислота (ПВК) подвергается преобразованиям, завершающимся в цикле трикарбоновых кислот (ЦТКК). На первом этапе этих превращений ПВК подвергается окислительному декарбоксилированию и преобразуется в ацетил-КоА – активную форму уксусной кислоты под действием мультиферментного комплекса. Каждый из ферментов этого комплекса катализирует определенную стадию этого этапа превращений. При этом ПВК взаимодействует с коферментом А (КоА), подвергается окислению НАД-зависимой дегидрогеназой и декарбоксилированию. Декарбоксилирование приводит к потере пировиноградной кислотой своей карбоксильной группы. Итоговое уравнение этой реакции можно представить следующим образом (рис. 35):
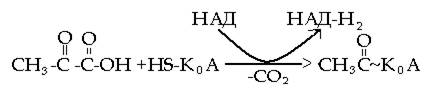
Пировиноградная Ацетил КоА
Рис.35. Схема превращения пировиноградной кислоты в ацетил-К А
Ацетил-КоА включается в превращения ЦТКК, где окисляется до СО2 и Н2 О. Включение ацетил-КоА в превращения ЦТКК не требуют затрат энергии, т.к. ацетильная группа в соединении с КоА находится в активированной форме.
Превращения цикла трикарбоновых кислот представены на рис. 36. 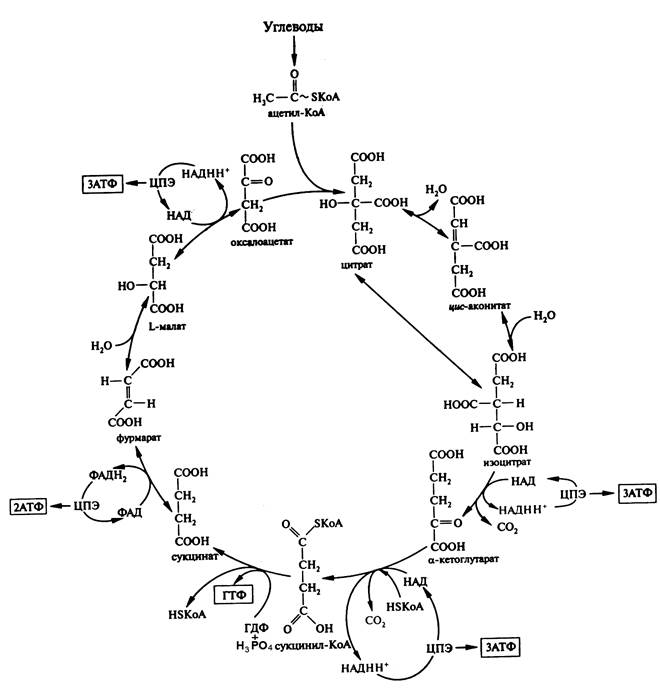
Рис. 36. Общая схема превращений цикла трикарбоновых кислот, где ЦПЭ – цепь переноса электронов
Окислительное декарбоксилирование пирувата экзергонический процесс. В пересчете на одну молекулу глюкозы на этом этапе происходит восстановление двух молекул НАД. За счет энергии, освобождающейся при их окислении, в дыхательной цепи митохондрий ресинтезируется шесть молекул АТФ.
Рассмотрим последовательные реакции цикла трикарбоновых кислот. Превращения цикла трикарбоновых кислот начинаются с взаимодействия ацетил-КоА с щавелевоуксусной кислотой (оксалоацетатом), катализируемого ферментом цитратсинтетазой. Еще одним участником этой реакции является молекула воды. В результате образуется лимонная кислота (цитрат) и свободный КоА (рис. 37).
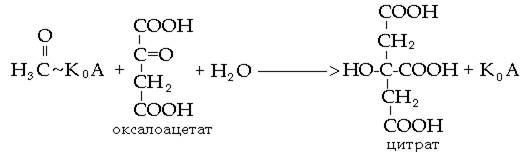
Рис. 37. Начальная реакция цикла трикарбоновых кислот
Образовавшаяся лимонная кислота вступает в реакцию изомеризации (внутримолекулярной перестройки), приводящей к образованию изолимонной кислоты (изоцитрата). Реакция идет через стадию образования промежуточного продукта цис-аконитата и катализируется ферментом аконитазой. Смысл этой реакции заключается в преобразовании трудно окисляемой лимонной кислоты в более легко окисляемую – изолимонную. Изолимонная кислота подвергается окислению НАД-зависимой дегидрогеназой, в процессе которого от нее отщепляются два атома водорода. Одновременно происходит ее декарбоксилирование – отщепление группы СО2. Итогом этой реакции является α-кетоглютаровая кислота, содержащая на один атом углерода меньше, чем изолимонная, и восстановленная форма кофермента дегидрогеназы (НАД-Н2).
Образовавшаяся в ходе этой реакции α-кетоглютаровая кислота (α-кетоглютарат) подвергается повторному окислению НАД-зависимой дегидрогеназой, приводящему к потере двух атомов водорода, и декарбоксилированию (отщеплению СО2). В реакции участвует также кофермент А. В результате этой реакции образуется комплексное соединение КоА с укороченной (по сравнению с α-кетоглютаровой кислотой) еще на один атом углерода янтарной кислотой – сукцинил-КоА и восстановленная форма дегидрогеназы (НАД-Н2).
Сукцинил связан с КоА макроэргической связью; дальнейшие превращения сукцинил-КоА обеспечивают трансформацию этой энергии в более удобную для организма форму – гуанозинтрифосфат (ГТФ). Реализуется это через реакцию с участием сукцинил-КоА, свободной фосфорной кислоты и ГДФ (гуанозиндифосфата). Образование в этой реакции ГТФ относится к т. н. субстратному фосфорилированию. Продукт этой реакции ГТФ сам может использоваться в качестве непосредственного источника энергии в некоторых энергопотребляющих процессах, или обеспечить ресинтез более универсального для организма источника энергии – АТФ по уравнению:
ГТФ + АДФ → ГДФ + АТФ
Образовавшаяся янтарная кислота подвергается еще одному окислению, на этот раз с участием ФАД-зависимой дегидрогеназы. Продуктами реакции являются фумаровая кислота и восстановленная форма кофермента дегидрогеназы – ФАД-Н2. Перенос водорода с ФАД-зависимой дегидрогеназы на кислород энергетически менее эффективный процесс, чем в случае окисления НАД-Н2. Он может обеспечить ресинтез только двух молекул АТФ.
Следующая стадия – превращение фумаровой кислоты в яблочную. Реакция происходит с присоединением воды и может рассматриваться как обогащение промежуточных продуктов цикла трикарбоновых кислот водородом, сопровождающееся внутримолекулярным перераспределением энергии.
На завершающем этапе цикла происходит окисление яблочной кислоты НАД-зависимой дегидрогеназой с образованием конечного продукта ЦТКК щавелево-уксусной кислоты, которая реагируя с ацетил-КоА дает начало новому циклу превращений трикарбоновых кислот.
Все реакции ЦТКК катализируются специфическими ферментами, обладающими высокой активностью, в силу чего не происходит накопления промежуточных продуктов цикла.
ЦТТК является тем этапом превращений веществ в организме, с которым связано освобождение и фиксация в макроэргических связях АТФ наиболее значительного количества энергии. Сами реакции ЦТКК (один оборот цикла) связаны с ресинтезом всего одной молекулы АТФ (через предварительное образование гуанозинтрифосфата). Основное количество АТФ ресинтезируется при переносе водорода на кислород по дыхательной цепи с восстановленных форм дегидрогеназ, которые окисляют первичные доноры водорода, образующиеся в превращениях ЦТКК. Включение в превращения ЦТКК одной молекулы ацетил КоА завершается образованием трех молекул восстановленной формы НАД-зависимой дегидрогеназы (3 НАД-Н2) и одной молекулы восстановленной формы ФАД-зависимой дегидрогеназы (ФАД-Н2). Перенос водорода с НАД-Н2 на кислород в дыхательной цепи обеспечивает ресинтез трех молекул АТФ, с ФАД-Н2 – двух молекул АТФ. Таким образом, энергетический эффект одного оборота ЦТКК составляет:
3 молекулы НАД-Н2 × 3 АТФ = 9 АТФ,
1 молекула ФАД-Н2 × 2 АТФ = 2 АТФ
Плюс одна молекула АТФ, ресинтезируемая в реакции субстратного фосфорилирования. Итого энергетический эффект одного оборота цикла ЦТКК составляет 12 молекул АТФ.
ЦТКК – универсальный путь катаболизма практически всех основных видов биомолекул: углеводов, липидов, аминокислот, которые включаются в эти превращения или через предварительное преобразование в ацетил-КоА, или через превращение в промежуточные продукты ЦТКК. Кроме того, что ЦТКК обеспечивает взаимосвязь катаболических и анаболических превращений различных соединений, он играет важную роль в анаболизме клетки, поставляя промежуточные метаболиты для процессов биосинтеза. Так, например, сукцинил-КоА служит субстратом для синтеза гема, α-кетоглутарат для синтеза глютаминовой кислоты и т.п. Следовательно, ЦТКК относится к амфиболическим процессам, связывая воедино катаболические и анаболические процессы.
Вопросы и задания для самоконтроля
1. Какие вещества относятся к углеводам? Как классифицируются углеводы? Назовите важнейшие представители углеводов разных классов и дайте им краткую характеристику.
2. Какие углеводы встречаются в важнейших продуктах питания? Какие из них подвергаются пищеварительным превращениям?
3. Какие превращения совершаются с углеводами в процессе пищеварения? Каковы пути использования в организме продуктов пищеварения углеводов?
4. Как осуществляются анаэробные превращения гликогена и глюкозы (гликолиз)? Какова энергетическая эффективность гликолиза?
5. Какие превращения происходят в аэробной фазе углеводного обмена?
6. Как превращения цикла трикарбоновых кислот (главного этапа аэробной фазы углеводного обмена) связаны с системой переноса протонов и электронов на кислород и ресинтеза АТФ?
7. Какова энергетическая эффективность аэробного окисления углеводов?
8. Какие химические превращения происходят в процессе устранения образующейся в ходе гликолиза молочной кислоты?
ПРЕВРАЩЕНИЕ УГЛЕВОДОВ В ПИЩЕВАРИТЕЛЬНОМ ТРАКТЕ;
Основными углеводами пищи для организма человека являются: крахмал, гликоген, лактоза, в незначительной степени моносахариды – глюкоза, фруктоза. Для современного человека значимое место стала занимать сахароза.
Переваривание углеводов в ротовой полости. Поступивший с пищей крахмал (гликоген) в ротовой полости подвергается гидролизу под действием альфа-амилазы слюны, которая относится к эндоамилазам. Она расщепляет альфа (1,4)-гликозидные связи в структуре крахмала. рН оптимум для альфа-амилазы слюны находится в слабощелочной среде (рН = 7-8). Так как пища в ротовой полости находится недолго, то крахмал метаболизируется лишь частично. Его гидролиз завершается образованием амилодекстринов. Известны следующие виды декстринов:
· амило-декстрины, эритродекстрины, ахродекстрины и. Амилодекстрины (молекулярная масса их около 10000, количество глюкозных единиц около 60);
· эритродекстрины – молекулярная масса около 7000, количество глюкозных единиц около 40;
· ахродекстрины – молекулярная масса их около 3700, количество глюкозных единиц около 20;
· мальтодекстрины – олигосахариды, содержащие от 2 до 20 остатков глюкозы. (malt – солод, англ.)
Далее пища поступает в желудок. Слизистой оболочкой желудка гликозидазы не вырабатываются. В желудке среда резко кислая (рН=1,5-2,5), поэтому действие альфа-амилазы слюны внутри пищевого комка прекращается. Однако в более глубоких слоях действие фермента продолжается, и крахмал успевает пройти следующую стадию гидролиза, с образованием эритродекстринов.
Переваривание углеводов в кишечнике.Основным местом переваривания крахмала служит тонкий отдел кишечника. Здесь проходит наиболее важная фаза гидролиза крахмала. В переваривании крахмала принимает участие ферменты, вырабатываемые в поджелудочной железе (альфа-амилаза, амило-1,6-гликозидаза и олиго-1,6-гликозидаза ).
Выделяющийся панкреатический сок содержит бикарбонаты, которые принимают участие в нейтрализации кислого желудочного содержимого, создаётся слабощелочная среда (рН=8-9) – оптимальная для гликозидаз. Образующиеся катионы (Na + , K + ) принимают участие в активации ферментов.
Три панкреатических фермента завершают гидролитический разрыв внутренних гликозидных связей в структуре крахмала. Эритродекстрины переходят в ахродекстрины.
Альфа-амилаза завершает разрыв внутренних альфа-(1,4)-гликозидных связей, амило-1,6-гликозидаза гидролитически расщепляет внутренние альфа-1,6-гликозидные связи в точках ветвления, а олиго-1,6-гликозидаза является терминальной в этом процессе.
Таким образом, три панкреатических фермента завершают гидролиз крахмала в кишечнике с образованием мальтоз (дисахарид, состоящий из двух остатков глюкозы, соединённых α-1,4-гликозидной связью) и изомальтоз (дисахарид, состоящий из двух остатков глюкозы, соединённых α-1,6-гликозидной связью) и триозосахаридов.
В щёточной каёмке тонкого кишечника на наружной поверхности цитоплазматической мембраны энтероцитов расположены ферментные комплексы, расщепляющие гликозидные связи в дисахаридах (дисахаридазы). У человека известно о четырёх ферментно-субстратных комплекса:
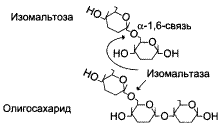
o сахаразо-изомальтазный комплекс. Прикреплён к мембране микроворсинок с помощью гидрофобного домена. Гидролизует сахарозу и изомальтозу, расщепляя α-1,2- и α-1,6-гликозидные связи, мальтозу и мальтотриозу – гидролизуя α-1,4-гликозидные связи. На его долю приходится 80% всей мальтазной активности кишечника. Сахаразная субъединица – единственный фермент в кишечнике, гидролизующий сахарозу, а изомальтазная субъединица с большей скоростью гидролизует связи в изомальтозе, чем в мальтозе и мальтотриозе. Активность комплекса высокая в тощей кишке, но снижается в проксимальной и дистальных частях кишечника.

Сахаразо-изомальтазный комплекс. 1 – сахараза, 2 – изомальтаза, 3 – связывающий домен, 4 – трансмембранный домен, 5 – цитоплазматический домен.

o Гликоамилазный комплекс – катализирует гидролиз α-1,4-гликозидные связи между глюкозными остатками в олигосахарах, действуя с восстанавливающего конца – экзогликозидаза. Может действовать как мальтаза. Активность наибольшая в нижних отделах тонкого кишечника.
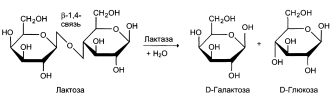
o β-гликозилазный комплекс (лактаза) – расщепляет β-1,4-гликозидную связь в молочном сахаре между галактозой и глюкозой. Является гликопротеином. Неравномерно распределён к кишечнике. Наиболее активен у плода в последние сроки беременности и до 5-7 летнего возраста. С возрастом – активность снижается (у взрослых составляет до 10% от детского возраста) у некоторых исчезает вовсе.
o Трегалаза – гидролизует связь между мономерами трегалозы – дисахариде грибов состоящей из двух остатков глюкозы, связанных гликозидной связью между первыми аномерными атомами углерода.
Транспорт глюкозы.
Гидролиз соответствующих дисахаридов пищи заканчивается образованием мономеров – глюкозы, галактозы, фруктозы, которые всасываются эпителиальными клетками тощей и подвздошной кишок с помощью специальных механизмов транспорта через мембраны этих клеток:
o путём облегчённой диффузии; Облегчённую диффузию обеспечивают белки-переносчики семейства ГЛУТ (GLUT или SLC2A). Они имеют 12 чрезмембранных спиральных доменов. Считается, что 3,5,7 и 11 трансмембранные сегменты образуют канал для глюкозы.
Глюкозные транспортёры (GLUT) обнаружены во всех тканях. Существует несколько разновидностей ГЛЮТ, они пронумерованы в соответствии с порядком их обнаружения. В настоящее время описанны 12 типов GLUT имеют сходные первичную структуру и доменную организацию.
§ ГЛЮТ-1 – широко распространён в клетках тканей плода, в эритроцитах, эндотелиоцитах гематоэнцефалического барьера. количество GLUT-1 повышается при низком уровне глюкозы.
§ ГЛЮТ-2 обнаружен в клетках канальцев почек, энтероцитах тонкого кишечника, клетках печени и β-клетках поджелудочной железы (играет роль сенсора глюкозы). Обеспечивает двунапраленное перемещение – при гликолизе – внутрь, при глюконеогенезе – наружу. Из энтероцитов в кровь ГЛУТ-2 переносит глюкозу, фруктозу и галактозу;
§ ГЛЮТ-3 – синтезируется в основном в нейронах (основная форма) и плаценты. Обладает высоким сродством к глюкозе;
§ ГЛЮТ-4 – главный переносчик глюкозы в клетки мышц (в т.ч. в кардиомиоциты) и жировой ткани. Контролируется инсулином; который стимулирует транслокацию специфичных GLUT-4 содержащих пузырьков из внутриклеточного пространства к плазматической мембране, что способствует немедленному увеличению транспорта глюкозы в 10-20 раз.
§ ГЛЮТ-5 – транспортирует только фруктозу. Встречается, главным образом, в клетках тонкого кишечника, яичках и почках.
§ ГЛЮТ-7 – при распаде гликогена в лизосомах (гликогенолизе) транспортирует глюкозу из эндоплазматической сети.
Все типы ГЛЮТ могут находиться как в плазматической мембране, так и в цитозольных везикулах. ГЛЮТ-4 (и в меньшей мере ГЛЮТ-1) почти полностью находятся в цитоплазме клеток. Влияние инсулина на такие клетки приводит к перемещению везикул, содержащих ГЛЮТ, к плазматической мембране, слиянию с ней и встраиванию транспортёров в мембрану. После чего возможен облегчённый транспорт глюкозы в эти клетки. После снижения концентрации инсулина в крови транспортёры глюкозы снова перемещаются в цитоплазму, и поступление глюкозы в клетку прекращается (рис. 7-19). Известны различные нарушения в работе транспортёров глюкозы. Наследственный дефект этих белков может лежать в основе инсулинонезависимого сахарного диабета. В то же время причиной нарушения работы транспортёра глюкозы может быть не только дефект самого белка. Нарушения функции ГЛЮТ-4 возможны на следующих этапах:
§ передача сигнала инсулина о перемещении этого транспортёра к мембране;
§ перемещение транспортёра в цитоплазме;
§ включение в состав мембраны;
§ отшнуровывание от мембраны и т.д.
После всасывания моносахариды покидают клетки слизистой оболочки кишечника через мембрану, обращённую к кровеносному капилляру, с помощью облегчённой диффузии.
Потребление глюкозы клетками из кровотока происходит так же с помощью облегчённой диффузии. Исключение составляют клетки мышц и жировой ткани, у которых облегчённая диффузия регулируется инсулином.
o путём активного транспорта (вторичный активный транспорт). Глюкоза и Na + проходят через мембраны с люминальной стороны, связываясь с различными участками белка-переносчика (НГЛТ – натрий зависимый транспортёр глюкозы) (sodium-dependent glucose transport (SGLT; SGLT-1, -2,-3). При этом натрий поступает в клетку по градиенту концентрации, и одновременно глюкоза транспортируется против градиента концентрации (вторичный активный транспорт). Т.е чем больше градиент Na + – тем больше поступление глюкозы в энтероциты и наоборот. Градиент концентрации Na + – движущая сила активного симпорта, создаётся работой Na + ,K + -АТФ-азой. Такой же механизм переноса и для галактозы. Активный транспорт особенно эффективен при низкой концентрации глюкозы. Если же концентрация глюкозы (фруктозы) в кишечнике велика, то она может транспортироваться в клетку путём облегчённой диффузии. Всасывание глюкозы и галактозы гораздо выше, чем других моносахаридов.
Продукты полного гидролиза – моносахариды – всасываются в кровь и на этом завершается начальный этап обмена углеводов – пищеварение.
С пищей в организм человека поступает клетчатка, которая в пищеварительном тракте не переваривается, поскольку отсутствуют бета -гликозидазы.
Однако биологическая роль клетчатки велика: она формирует пищевой комок, продвигаясь по желудочно-кишечному тракту она:
· нормализует кишечную микрофлору (место обитания
3 кг микроорганизмов);
· раздражает слизистые оболочки, усиливая сокоотделение;
· клетчатка усиливает перистальтику кишечника;
· достигая отделов толстого кишечника клетчатка под действием ферментов условно-патогенной микрофлоры подвергается брожению с образованием глюкозы, лактозы и газообразных веществ.
Источники:
http://studopedia.ru/16_82403_prevrashchenie-uglevodov-pri-proizvodstve-pishchevih-produktov.html
http://helpiks.org/5-93135.html
http://studopedia.su/5_49971_prevrashchenie-uglevodov-v-pishchevaritelnom-trakte.html





