Разделение и идентификация коллоидов вина электрофорезом – Коллоидные явления в винах
Разделение и идентификация коллоидов вина электрофорезом – Коллоидные явления в винах
Разделение и идентификация коллоидов вина электрофорезом – Коллоидные явления в винах





Определение коллоидов в сусле и вине
Производство высококачественных вин требует от винодела тонких дегустационных способностей, своеобразного таланта, расширяемого опытом. Но при всех достоинствах дегустационная оценка носит в некоторой мере субъективный и общий характер.
Дегустатор часто не в состоянии охарактеризовать роль отдельных соединений, которые влияют на органолептические качества продукта. Неудивительно, что искусство виноделия и, в частности, дегустации все больше обогащается более объективными аналитическими показателями, которые убедительно дополняют органолептические характеристики. Среди этих объективных характеристик значительную роль нужно отвести коллоидной фракции вина и сока.
Сравнение вина с живым организмом, который развивается, созревает, стареет и умирает, возможно только благодаря содержанию в нем коллоидной фракции. Коллоиды сообщают вину специфику, отличающую его от других водно-спиртовых растворов.
В то же время коллоиды имеют большое значение, как вещества, изменяющие органолептические признаки вина. Они могут стабилизировать прозрачность и цвет, придавать букету устойчивость, вызывать постепенное воздействие ароматических и вкусовых веществ на наши органы чувств и дают возможность полнее выявиться всему комплексу свойств вина, в том числе мягкости, бархатистости, гармоничности, сорбиции углекислоты (в игристом).
Изучение коллоидов вина может преследовать различные задачи. Коллоиды, как в приведенном (без сахара), так и в общем экстракте, играют (если не по количеству, то по качеству) основную роль.
Для определения степени экстрактивности вина важно знать общее количество в нем коллоидов.
При оценке сравнительной устойчивости вина против помутнения, наряду с общим количеством, нужно определять количество гидрофильных и гидрофобных коллоидов (обратимых и необратимых), а также наличие в коллоидах камеди (реакция с флорглюцином).
Поэтому значение коллоидов для виноделия трудно преувеличить.
Не меньшее значение имеет исследование коллоидов при разработке технологии соков, так как при сохранении коллоидов во многом сохраняются диетические качества сока.
Учитывая значение коллоидов для вин и соков и специфику их состава в зависимости от сорта винограда, нетрудно понять, что и в селекции винограда необходимо учитывать важную роль коллоидов.
Наконец, вино – интереснейший объект для теоретических коллоидно-химических исследований.
Для того чтобы составить наиболее полное представление о свойствах коллоидов, скажем несколько слов о дисперсных системах.
Дисперсные системы, в том числе и коллоидные, состоят из дисперсной фазы и дисперсионной среды. Дисперсная фаза сока и вина – это белковые и пектиновые вещества, камеди, растительные слизи, а также продукты дегидратации и полимеризации их и дубильных и красящих веществ. Дисперсионная среда для сока – вода, для вина – водно-спиртовая смесь.
По степени дисперсности, или по величине частиц, твердые вещества сусла и вина можно разделить на следующие фракции:
1. Макроскопическая дисперсность с поперечником частиц не менее 0,1 миллиметра. Последние представлены сильно агрегированными коллоидными хлопьями, кристаллами и агрегированными микроорганизмами, взвесь которых легко выпадает в осадок.
2. Микроскопическая дисперсность с поперечником частиц от 0,1 микрона до нескольких сотых долей миллиметра. Эти частицы представлены отдельными микроорганизмами, а также связанными в небольшие колонии, слабо агрегированными коллоидными хлопьями и мелкими кристаллами. Мельчайшие из них обладают броуновским движением, т. е. кинетически относительно устойчивы, что значительно усложняет отстой, фильтрацию, центрифугирование, различные оклейки или обработки адсорбентами. Отсюда неудачи при стерилизации методами удаления микроорганизмов.
Не менее сложна стерилизация высокими температурами, лучевой энергией, ультразвуком, так как споры или часть их надежно (за счет обезвоживания тормозных систем и оболочки) защищены от реакции на внешние воздействия. Поэтому осветление и консервирование продукта успешно осуществляется на практике только тогда, когда репродуктивные органы микроорганизмов не могут развиваться из-за отсутствия в среде одного из жизненно необходимых факторов, например кислорода, тепла, минерального или азотистого питания. На этом основан предложенный нами около 30 лет назад способ предупреждения дрожжевых помутнений столовых вин.
3. Коллоидная дисперсность с поперечником частиц от одного миллимикрона до нескольких сотых долей микрона. Такие частицы состоят из многих молекул-полимеров, обладают довольно большим объемом, сложным строением и поверхностью раздела между частицами (мицеллами) и средой.
Величина поверхностной энергии частиц имеет очень большое значение для устойчивости их размера, а также общей структуры дисперсной системы. В свою очередь, размер частиц и общая структура дисперсной системы определяют органолептические свойства сока – цвет, прозрачность, аромат, вкус.
Это положение закономерно для коллоидного состояния вещества. Известно, например, что в зависимости от размера частиц коллоидные гидрозоли серебра окрашены в синий, фиолетовый, красный или желтый цвета, в то время как ионы серебра бесцветны.
Интенсивность мутности также зависит не только от количества мутящих частиц, но и от их размера.
Изменение цвета, как правило, предшествует помутнению. Большое влияние оказывает коллоидная фракция на аромат и вкус сока. Это связано со специфическими свойствами коллоидной, полимерной, системы сока.
Полимерные частицы представлены в соке как гидрофильными, так и гидрофобными коллоидами – белковыми, а также усложненными образованиями дубильных и красящих веществ, пектином, камедью, фосфоросодержащими веществами, растительной слизью и продуктами их окисления, дегидратации и полимеризации. Все коллоидные частицы кинетически устойчивы, а гидрофильные коллоиды имеют, кроме того, связь с дисперсионной средой (растворителем).
Потеря устойчивости гидрофобных частиц (в силу присущей им тенденции к агрегации) связана с их укрупнением, а гидрофильных – с дегидратацией, главным образом в связи с окислением и последующей полимеризацией через образовавшийся кислородный мостик.
Стабилизация гидрофильного золя основана на предупреждении его окисления или же на предупреждении агрегации дегидратированных и полимеризованных частиц. Согласно нашим исследованиям * последнее достигается применением коллоида с большой защитной силой, стойкого к химическим изменениям (например, камеди плодовых культур). Так, камедь некоторых косточковых пород при применении ее в процессе окончательной фильтрации хорошо защищает соки и вина при дозировке 5-10 мг/л.
* (Авторское свидетельство № 58912)
Подбирая к дисперсной фазе подходящую дисперсионную среду и соответствующие стабилизаторы, можно любому веществу, независимо от того, является ли оно по природе кристаллическим или аморфным, придать коллоидное состояние с присущими ему свойствами.
В наиболее яркой форме свойства коллоидов проявляются при определенной степени дисперсности частиц вещества, равной 10 5 -10 7 и поперечнике их а = 10 -5 -10 -7 сантиметров.
Молекулярная дисперсность составляет примерно 10 8 , так как диаметр молекул равен 10 -8 сантиметров. Частицы диаметром 10 -5 , 10 -3 сантиметров легко различимы под микроскопом.
С изменением степени дисперсности частиц изменяются их свойства.
На рисунке 3 показана группировка веществ сока и вина по физическому состоянию (степени дисперсности). Как видно из рисунка, поверхностное натяжение (обозначено кривой σ) при степени дисперсности от микроскопической до грубоколлоидной не изменяется, а затем, при переходе к молекулярной дисперсности, резко падает и исчезает.
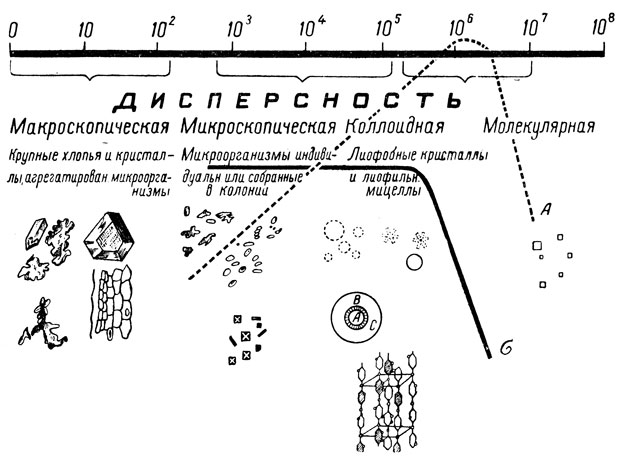
Рис. 3. Группировка веществ сока по физическому состоянию
Еще интереснее выглядит кривая удельной поверхностной энергии системы (А). Она достигает максимума у частиц с коллоидной дисперсностью.
Эти интересные зависимости были найдены А. В. Думанским в 1913 году.
Перейдем к изложению методики исследования коллоидов.
Для определения коллоидной фракции используется метод осаждения коллоидов спиртом-эфиром.
Определение общего количества коллоидов нужно начинать с нахождения оптимальной точки коагуляции по так называемому треугольнику коагуляции (рис. 4).
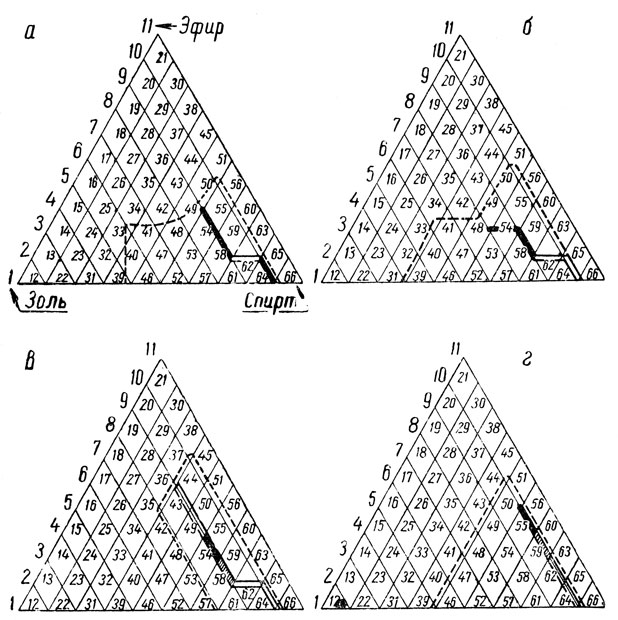
Рис. 4. Треугольники коагуляции: а, б – белых виноматериалов; в, г – красных виноматериалов
Для каждого номера системы в треугольнике соотношение золя – спирта – эфира постоянно. Это соотношение, обозначаемое порядковым номером, мы будем называть точкой треугольника коагуляции.
Каждая вершина приведенного на рисунке 4 равностороннего треугольника соответствует максимальному количеству одного из трех компонентов коагулирующей смеси, выражаемой десятью объемами.
На стороне, противоположной углу, расположены нулевые точки данного компонента.
Таким образом, отсчет производится от 10 до 0 (11 измерений), причем по мере удаления от угла к противоположной стороне количество компонента уменьшается на единицу по каждому параллельному ряду цифр.
Согласно нашим исследованиям чаще оказываются приходными следующие точки коагуляции (табл. 11):
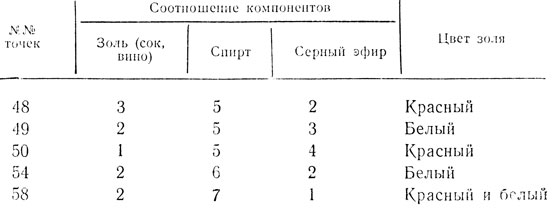
Таблица 11
Техника определения. Для осаждения коллоидов по найденной точке в конические колбочки на 100-150 миллилитров отмеривают вино, спирт, эфир в количестве, соответствующем взятой точке коагуляции, но при увеличении дозировки каждого компонента в 10 раз, чтобы смеси было 100 миллилитров (для уменьшения ошибки при пересчете). Смесь энергично взбалтывают и оставляют на ночь.
Осевший к следующему дню осадок коллоидов после декантации переносят с помощью промывной смеси для данной точки (т. е. раствора, в котором золь заменен дистиллированной водой) на беззольный фильтр, заранее высушенный и взвешенный.
При определении коллоидов в суслах с повышенной кислотностью желательно ускорять определение путем нагрева с обратным холодильником в течение 15-20 минут и фильтрования через 30-40 минут после охлаждения. Общее количество промывной смеси на каждый осадок – 70-80 миллилитров.
После промывания фильтры с осадком вкладывают в те же бюксы и помещают в водяной сушильный шкаф для определения постоянного веса, на что требуется 2-2,5 часа.
В тех случаях, когда нужно установить не только общее количество, но и количество обратимых и необратимых коллоидов, в сушильный шкаф пропускают углекислоту.
Для разделения и определения количества гидрофильных и гидрофобных коллоидов высушенный в атмосфере СО2 и взвешенный осадок коллоидов вместе с фильтром снова вкладывают в воронку и растворяют (пептизируют) теплой дистиллированной водой. Если фильтр промывать небольшими порциями теплой (45-50°) дистиллированной воды, выжидая, пока она полностью стечет, то для растворения всех гидрофильных коллоидов вполне достаточно 35-40 миллилитров воды.
Для определения количества гидрофобных коллоидов фильтр с осадком, оставшимся после пептизации гидрофильных коллоидов, вкладывают в бюкс и высушивают. По разности между весом фильтра с общим количеством коллоидов и веса его с гидрофобными коллоидами определяют количество гидрофильных коллоидов, а по разности между весом фильтра с гидрофобными коллоидами и пустого фильтра – вес гидрофобных коллоидов. Осадок гидрофобных коллоидов анализируется на общий азот, фосфор и тяжелые металлы (Fe, Pb, Cu), причем фильтрат гидрофильных коллоидов лабилен и его следует анализировать сразу, а осадок гидрофобных коллоидов можно сохранять для анализов впрок.
Полученный фильтрат идет для исследования гидрофильных коллоидов, в нем определяют физико-химические показатели – поверхностное натяжение, вязкость, Eh и химические – азот, фосфор, камеди (реакция с флорглюцином).
Основные показатели состава сусла и вина говорят не только о настоящем, но и в некоторой степени о будущем состоянии продукта. Однако, чтобы точнее прогнозировать, как изменится продукт, необходимо представлять хотя бы основные факторы или причины, с которыми связано его изменение.
Устойчивость коллоидных растворов. Коагуляция. Пептизация
Под устойчивостью коллоидного раствора понимают постоянство основных свойств этого раствора: сохранение размеров частиц (агрегативная устойчивость) и равномерное распределение частиц по всему объему (седиментационная или кинетическая устойчивость).
Лиофобные золи термодинамически неустойчивы, с течением времени происходит укрупнение коллоидных частиц, а затем выпадение их в осадок. Процесс слияния мицелл коллоидных растворов и выпадение их в осадок называется коагуляцией. Коагуляцию могут вызвать следующие факторы: изменение температуры (например, сильное охлаждение); механическое воздействие (например, интенсивное встряхивание или перемешивание); действие света и различного рода излучений; действие электрического заряда; действие электролитов, добавляемых к коллоидному раствору; добавление другого коллоидного раствора с зарядом гранулы противоположным заряду гранулы исходного золя.
Процесс коагуляции происходит в две стадии: скрытая коагуляция – при этом происходит укрупнение частиц, но не наблюдается внешних изменений; и явная коагуляция – при этом наблюдается изменение цвета, выпадение осадка, появление мути.
Правило Шульце-Гарди: коагуляцию коллоидных растворов вызывает не весь электролит, а только тот его ион, который противоположен по заряду гранулы. Причем чем выше заряд коагулирующего иона, тем меньше этого вещества необходимо для коагуляции.
Механизм коагуляции объясняет теория, предложенная И. П. Песковым. Согласно этой теории, ион, вызывающий коагуляцию отнимает сольватную (гидратную) оболочку от ионов диффузного слоя, которые переходят в дальнейшем в адсорбционный слой гранулы. Термодинамическая устойчивость системы снижается, увеличиваются силы притяжения между мицеллами, т. е. вандерваальсовы силы и уменьшаются силы отталкивания между ними (отталкивание происходит за счет наличия одноименного электрического заряда у коллоидных частиц). Следовательно, сталкивание мицелл приводит к их слиянию, и в конечном итоге – к коагуляции. Коагуляция золей способствует уменьшению площади поверхности частиц, и за счет этого – снижению свободной поверхностной энергии, а, следовательно, и увеличению термодинамической устойчивости системы.
Устойчивость коллоидно-дисперсных систем может быть достигнута за счет проведения диализа – процесса очистки коллоидных растворов от посторонних примесей, находящихся в дисперсионной среде. Этот процесс проводят в диализаторах. Простейший диализатор состоит из цилиндра, дно которого затянуто полупроницаемой мембраной. Цилиндр наполняют коллоидным раствором и помещают в сосуд с дистиллированной водой. Через мембрану проходят растворенные в воде примеси и задерживаются мицеллы.
Другой способ увеличения устойчивости коллоидных растворов это введение в них соответствующего высокомолекулярного вещества (например, белка, полисахарида, желатина и т.д.).
Процесс обратный коагуляции – пептизация. При пептизации частицы, находящиеся в рыхлом осадке, адсорбируют на своей поверхности одноименные заряды, отталкиваются друг от друга и переходят в раствор, образуя золь. Вещества, способствующие пептизации, называются пептизаторами. Например, пептизацию гидрозоля железа (Fe(OH)2), находящегося в осадке, можно вызвать, добавив раствор хлорида железа (III) FeCl3 . При этом на поверхности осадка начинают адсорбироваться ионы Fe +3 , образуя диффузный слой. Частицы, находящиеся в осадке, отталкиваются друг от друга и переходят в объем во взвешенном состоянии образуя коллоидный раствор. Процесс пептизации проходит за счет увеличения сил отталкивания между частицами.
Физико-химические помутнения вина
Они являются наиболее распространенными, сложными по составу и разнообразными по причинам, которые их вызывают. В соответствии с причинами они подразделяются на три основные группы: кристаллические, коллоидные и металлокассовые.
Кристаллические помутнения связаны с выпадением в осадок труднорастворимых солей винной кислоты на основе калия и кальция, иногда с участием солей щавелевой и слизевой кислот.
Эти помутнения возникают при понижении температуры, после спиртования, удаления защитных коллоидов, повышения величины рН, увеличения количества кальция, например за счет обработки вина бентонитом и других причин.
Процесс кристаллизации протекает в два этапа: сначала появляются зародыши кристаллов — центры кристаллизации, затем происходит рост кристаллов за счет свободных валентных связей, образующихся на углах и ребрах кристаллов. У молодых вин, насыщенных тартратами, благодаря взвешенным частицам мути и обилию коллоидов кристаллизация солей винной кислоты происходит очень медленно.
Поэтому, полезны оклейка и фильтрация молодых вин, способствующие выпадению кристаллических осадков. Калиевые соли дают в осадке продолговатые кристаллы с острыми углами, кальциевые — крупные кристаллы с гладкой поверхностью.
При излишнем введении в сусло или вино карбоната кальция наблюдается помутнение, связанное с образованием двойной соли винной и яблочной кислот. Кристаллы этой соли имеют ежиковидную или пучкообразную форму.
Для испытания виноматериалов на склонность к кристаллическим помутнениям к 10 мл вина добавляют несколько кристаллов винного камня и выдерживают в холодильнике 1—2 суток при температуре минус 3—4°С для столовых и минус 7—8°С для крепких вин. Последующий анализ полученных осадков по специальной методике позволяет определить устойчивость вина к кристаллическим помутнениям.
Коллоидные помутнения возникают в результате коагуляции находящихся в коллоидном состоянии веществ или вследствие физико-химических реакций составных веществ вина, переходящих из ионного в неустойчивое коллоидное состояние.
К коллоидным помутнениям относятся белковые, полифенольные, полисахаридные, липидные и комплексные (белково-полисахаридно-полифенольные). Они делятся на две группы по температурному фактору воздействия: необратимые и обратимые. Так, при нагревании вина происходят необратимая коагуляция и осаждение белков и других коллоидов. Обратимые помутнения возникают при охлаждении вина. Если помутневшее на холоде вино нагреть, коллоидная муть исчезает.
Механизм коллоидных помутнений объясняется электрической заряженностью коллоидных частиц и электрохимическими процессами, происходящими в коллоидных и коллоидно-ионных растворах.
Электрический заряд образуется в результате адсорбции на поверхности коллоидных частиц ионов или анионов, сообщающих отрицательный заряд, или катионов, которые сообщают положительный заряд. Из различных ионов электрозаряженность коллоидных частиц вина чаще всего определяется катионами Н+ и анионами ОН-, которые сообщают им соответственно положительный и отрицательный заряды.
В связи с этим при нормальной величине рН положительный заряд имеют некоагулированные протеины (белки) вина, оклеивающие вещества органического происхождения (желатин, рыбный клей), целлюлоза. Отрицательно заряжены таннин, пектиновые вещества, бентонит, диатомит, свернувшиеся от нагревания и коагулированные таннином протеины, берлинская лазурь, наконец, все мелкие, суспендированные в вине взвешенные частицы.
Переход коллоидов из золя (прозрачный раствор) в гель (мутный раствор) и составляет суть коллоидных помутнений. Чтобы избавиться от этого состояния коллоидов, их необходимо подвергнуть коагуляции и седиментации (выпадению в осадок).
Для коагуляции гидрофильных и гидрофобных коллоидных частиц необходимо снять электрическую заряженность и обеспечить дегидратацию коллоидов. Дегидратации способствуют нагревание, внесение спирта или таннина, наличие солей. Снятие электрической заряженности происходит при соприкосновении с противоположно заряженными частицами. На этом основаны почти все виды оклейки и фильтрации соков и вин, взаимное осаждение противоположно заряженных коллоидов, происходящее во время естественной длительной выдержки помутневших вин.
Коллоидные помутнения являются наиболее частыми (составляют более 50% всех помутнений вин) и трудноустранимыми. Их возникновению способствуют повышенное содержание протеинов (более 15 мг/л), фенольных веществ, полисахаридов, липидов, использование недостаточно зрелого винограда, последних прессовых фракций сусла, высокое для белковых и, наоборот, низкое для фенольных помутнений значение рН и температуры.
Происхождение обратимых и необратимых коллоидных помутнений, их прогнозирование устанавливают по специальной методике, основанной на температурных перепадах (от минус 3 до плюс 75 °С), выделении и анализе получаемых осадков.
Металлокассовые помутнения вызываются наличием в вине соединений тяжелых металлов — железа, меди, олова и др., вступающих во взаимодействие с другими компонентами — фенольными веществами, фосфатами, сульфидами, белками, в результате чего образуются помутнения коллоидного характера.
В винах наиболее часто встречаются железный, медный и белый кассы.
Железный касс, называемый иногда почернением вина, встречается чаще всего. Действительно, при содержании трехвалентного железа более 12—15 мг/л и свободном доступе воздуха вино чернеет, приобретая неприятный железистый привкус.
При этом железо взаимодействует с фенольными веществами, интенсивно окисляя все ценные и трудноокисляемые ароматические и экстрактивные вещества вина. Источником железа служат металлические незащищенные поверхности сборочных бункеров, емкостей и технологического оборудования. Железный касс исчезает в бескислородных условиях.
Белый касс вызывается взаимодействием железа с фосфатами. Он характеризуется появлением в вине сизо-белесых оттенков, образованием аморфных светлых осадков, часто сизовато-черного цвета. Флокуляции железофосфатных соединений способствуют катионы калия, кальция, магния.
Медный касс при наличии меди 0,15 г/л и выше возникает (в противоположность железному кассу) в анаэробных условиях и исчезает в присутствии воздуха.
Склонность вин к металлокассовым помутнениям выявляют путем прибавления к 100 мл вина 5 капель 3%-ного пероксида водорода и выдержки в течение 2 суток. Если появляется осадок бурого цвета, не растворяющийся в растворе гидросульфита натрия, то вино нестойко к металлокассовым помутнениям.
Источники:
http://wine.historic.ru/books/item/f00/s00/z0000037/st011.shtml
http://studopedia.ru/3_78019_ustoychivost-kolloidnih-rastvorov-koagulyatsiya-peptizatsiya.html
http://vinocenter.ru/fiziko-ximicheskie-pomutneniya-vina.html





