Пероксидаза – Превращения в винограде
Пероксидаза – Превращения в винограде
Превращения в винограде – Оксидоредуктазы
Содержание материала
Оксидоредуктазами, или иногда просто оксидазами, называют различные ферменты, которые катализируют реакции биологических окислительно-восстановительных процессов. Их подразделяют на два основных типа: трансгидрогеназы, или гидрогентрансферазы, которые катализируют перенос водорода с одной молекулы на другую, и оксигентрансферазы, которые катализируют фиксацию кислорода на субстрате. Именно ко второму типу и принадлежат оксидоредуктазы, достоверно характеризуемые в винограде, в частности тирозиназа и лакказа. Комиссией по ферментам Международного союза биохимии дано им следующее определение: «они используют дифенолы и другие близкие к ним вещества в качестве доноров (электронов), с одной стороны, и молекулярный кислород как акцептор — с другой» (Диксон и Уэбб, 1964). Эта группа, которая содержит кроме того, аскорбиноксидазу, характеризуется присутствием меди, связанной с молекулой белка.
В отношении винограда Лаборд (1896) первым констатировал, что основной источник оксидазы, ответственной за оксидазный касс, находится в гнили винограда и утверждение Мартинана (1895а, 1895b) о присутствии оксидазы в винограде не показательно. Опубликованные в последующие годы многочисленные работы по этому вопросу, относящиеся к оксидазе виноградной ягоды, не позволяют объяснить разницу в поведении между здоровым и гнилым виноградом в отношении оксидазного касса. Полную библиографию этих работ можно найти в разработках Дейбнера и Рифан (1963) и Пу (1967). Кроме того, сообщалось о присутствии других оксидоредуктаз: пероксидазы (Касиньяр, 1963; Иванов и Иванова, 1968; Пу и Урнак, 1972) и каталазы (Пу, 1967). Но похоже, что роль последнего фермента очень ограничена. Недавние работы, выполненные в Бордо (Дюберне и Риберо-Гайон, 1973а, 1973b, 1974а, 1974b), позволили прояснить эту проблему. Четко различаются две оксидоредуктазы: тирозиназа, которая присутствует во всех ягодах, и лакказа, специфическая для гнили, вызываемой Botrytis cinerea. Различия в активности этих двух ферментов позволяют объяснить разницу в поведении здорового винограда и винограда с гнилью в отношении оксидазного касса.
Нужно также отметить, что широко используемый в энологии термин «полифенолоксидаза» следует рассматривать как синоним тнрозиназы, и объединение тирозиназы и лакказы под общим названием «полифенол оксидаза» создает риск введения в терминологию дополнительных неточностей. Поэтому авторы будут избегать употребления термина «полифенолоксидаза», а будут использовать название «тирозиназа» для фермента винограда и название «лакказа» для фермента, выделяемого грибом Botrytis cinerea.
Тирозиназа винограда
Этот фермент, открытый в конце прошлого века (Бертран, 1896b, 1896с; Буркело, 1896а, 1896b, 1896с), стал предметом очень многих работ. Число растительных и животных видов, в которых была обнаружена тирозиназа. очень велико. Описание источников тирозиназ можно найти в разработках
Даусона и Тарили (1951) и в докторской диссертации Дюберне (1974).
Активность фермента. Тирозиназа обладает двумя видами активности, соответствующими окислению кислородом двух различных групп фенольных соединений:
1. Активность о-дифенольная, вызывающая образование о-хинона; речь идет о катехолазной активности тирозиназы 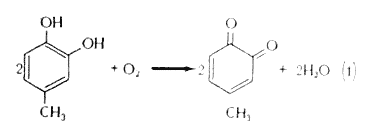
2. Активность монофенольная, ведущая через гидроксилирование к образованию о-дифенола; речь идет о крезол азной активности тирозиназы 
Затем о-дифенол окисляется в о-хинон по формуле (1), и крезолазную активность тирозиназы можно записать следующим образом (Мальмстрем и Риден, 1968):
Но окисление о-дифенолов тирозиназой не останавливается на о-хиноне, оно завершается образованием полиме-рнзованных соединений сложной структуры с коричневой окраской — меланинов. Мазон (1955) дал полный перечень соединений, реагирующих с хинонами. Дюберне (1974) исследовал механизмы активности тирозиназы (а также лакказы) и указал на большую сложность проблемы, так как о-хиноны, будучи мощными восстановителями, могут окислять натуральные вещества или вещества, добавляемые в сусло, чтобы возвратиться в положение о-дифенола и снова участвовать в ферментативном окислении, когда весь окислитель будет израсходован (Кордонье, 1971).
Многочисленные работы показали, что тирозиназа связана с хлоропласта-ми у многих видов растений и, особенно в винограде vitis vinifera (Гарел и Мейер, 1971).
Экстракция фермента. Чтобы исследовать тирозиназу винограда и измерить ее активность, необходимо приготовить неочищенный экстракт фермента, метод получения которого должен быть возможно более простым и быстрым, воспроизводимым, стабильным, по крайней мере, в течение некоторого времени. Экстракт фермента не должен содержать полифенолов и должен иметь максимальную активность.
Из двух методов приготовления неочищенного экстракта, применяемых на практике, тот, в котором предусматривается приготовление ацетонового порошка (Пу, 1966), неудобен, так как не дает достаточно стабильного экстракта, в то же время при этом способе происходит одновременная экстракция тирозиназы и лакказы, когда последняя присутствует.
Метод, описанный Гарелем и Мейером (1971), был несколько упрощен Дюберне (1974) с целью сокращения продолжительности процесса экстракции, чтобы ограничить денатурацию фермента и облегчить сравнение большого числа партий винограда.
Принятая схема 1 выделения неочищенного экстракта фермента тирозинадзы приведена ниже. Исходные растворы: 50 г винограда при —20°С +100 мл.
Схема 1 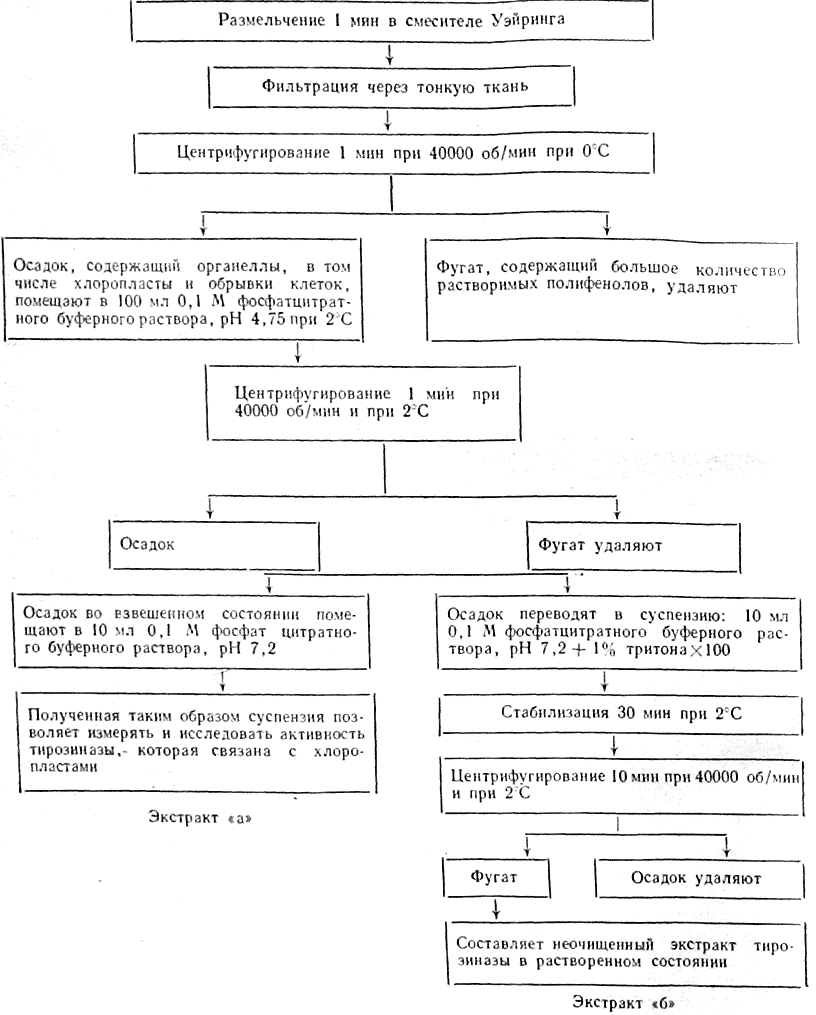
0,1 М фосфатцитратного буферного раствора, рН 7,2 при 20°С + 200 мг аскорбиновой кислоты.
Активность частиц на 1 г свежей массы винограда четырех экстрактов, полученных из одной и той же партии винограда сорта Мальбек (Дюберне, 1974), приведена ниже.
Номера экстрактов 12 3 4
Активность частый, ед. 1940 1970 2080 1850
Очистку сырого экстракта никогда не удавалось сделать полной вследствие изменений структуры, которым подвержена тирозиназа винограда. С другой стороны, частичная очистка, позволяющая исследовать её методами электрофореза или электрофокусирования, возможна (Дюберне, 1974).
Превращения в винограде – Классификация пектолитических ферментов
Содержание материала
Ферменты, действующие на пектиновые вещества, разделяют на две группы: деэтерифицирующие и деполимеризующие.
Деэтерифицирующие пектолитиче-ские ферменты. Это эстеразы, которые катализируют деметоксилирование пектинов и их превращение в пектиновую кислоту. Их называют пектинметилэстеразами (ПМЭ) или пектинэстеразами (ПЭ).
Деметоксилирующую активность пектинметилэстераз чаще всего исследовали путем количественного анализа высвобожденного метанола. При точно определенных условиях (40°С, в течение 1 ч, при рН 5,0) эти эстеразы очень специфичны по отношению к сложным метиловым эфирам и обычно высвобождают метиловые группы одна за другой в определенной последовательности, начиная чаще всего с конца цепи (см. рис. 2.22).
Деполимеризующие пектолитические ферменты. Эти энзимы принадлежат к двум категориям: гидролазы и трансэлиминазы, или лиазы. Гидролазы включают полиметилгалактуроназу (ПМГ), основным субстратом которой является пектин, и полигалактуроназу (ПГ), субстратом которой является пектиновая кислота. Приставки «эндо» и «экзо» позволяют классифицировать эти ферменты в зависимости от того, действуют ли они беспорядочно внутри цепей (эндо) или последовательно с конца цепей (экзо), следовательно, первые производят более эффективное деполимеризующее действие, чем последние. Они вызывают разрыв гликозидной связи 1—4 при простом гидролизе.
Трансэлиминазы включают также пектинтрансэлиминазы (ПТЭ), субстратом которых является преимущественно пектин, и трансэлиминазпекти-новую кислоту (ТЭПК), субстратом которой является пектиновая кислота. Приставки «эндо» и «экзо» также применимы к этим ферментам, как и к гнд-ролазам. Они вызывают разрыв гликозидной связи 1—4 путем трансэлиминации, т. е. этот разрыв между полуацетальным кислородом и углеродом 4 сопровождается удалением водорода, расположенного в транспозиции на углероде 5, в результате чего образуется двойная связь между этими двумя углеродамн (Альберсхайм и сотрудники, 1960). Эти ферменты, часто встречающиеся в микроорганизмах, очень редко обнаруживают в растениях.
Активность деполимеризующих ферментов измеряют по уменьшению вязкости, что позволяет учитывать активности эндо- и экзоферментом. Дело в том, что с эндоферментом вязкость уменьшается наполовину, поскольку при этом разрывается только от 2 до 3% гликозндных связей, тогда как с экзоэнзимом такое же снижение вязкости наблюдается только после разрыва более 40% этих связей.
Эти два типа ферментов, несомненно, существуют в винограде, и в частности пектннметнлэстераза (Марто 1967а).
Активность, протопектиназы все еще является предметом горячей дискуссии, в отношении винограда (Марто, 1967b) она может быть простым выражением активностей типа эндополигалактуроназы или эндополиметилгалак-туроназы под действием других ферментов— гемицеллюлаз и целлюлаз.
Факторы, влияющие на активность этих ферментов
Среди различных физических и химических факторов, влияющих на активность перечисленных выше ферментов, наиболее важным является температура. Во всех случаях максимум активности констатируют в зоне 35— 50°С. При температуре ниже 10°С активность очень . мала, а между 10 и 35°С она примерно удваивается при повышении температуры на 7°С; с другой стороны, при температурах выше 65°С активность уменьшается и полностью прекращается при температурах выше 70°С.
рН также играет важную роль. Обычно оптимальные значения его заключаются между 4 и 5 для ПМЭ и между 2,5 и 5 для ПМГ. Это показывает, что рН сусла (который всегда находится в пределах, оптимальной зоны) не влияет на деполимеризующне ферменты, тогда как активность ПМЭ при более низких рН (менее 3,0) значительно уменьшается.
Сернистый ангидрид, действие которого на большинство ферментов очень четко выражено, не оказывает какого-либо значительного влияния на пектолитические ферменты. Содержание сернистого ангидрида примерно 100 мг/л или менее не оказывает никакого действия на ферментативную активность и только при концентрации 300 мг/л можно рассчитать на снижение пектолитнческой активности примерно на 20%.
Бентонит частично адсорбирует эти ферменты и понижает их активность в более или менее значительной степени. Содержание спирта до 15% об. также практически не оказывает влияния, замедление ферментативной активности наблюдают при более высокой спиртуозности.
Технологическое значение пектолитических ферментов
Эти ферменты участвуют в спонтанном осветлении сусел (во время очистки сусла отстаиванием) и вин (во время хранения). Следовательно, их нужно всемерно сохранять и избегать разрушения их нагреванием дробленого (или целого) винограда или сусла. В случае, когда природные ферменты находятся в недостаточном количестве или разрушены, можно поправить дело добавлением промышленных препаратов, на применение которых только что дано официальное разрешение.
Ферменты группы оксидоредуктаз винограда и вина
Основные ферменты винограда и вина группы Оксидоредуктаз.
Полифенолоксидаза (о-дифинолоксидаза). Играет важную роль в дыхании виноградного растения и ОВ (окислительно-восстановительных) – процессах в сусле. Катализирует при доступе воздуха в реакции окисления полифенолов в хиноны.

Полифенолоксидаза (П. Ф.О.) очень активный фермент, ускоряющий окислительные процессы в сусле. Процесс этот необратим, а хиноны, быстро полимеризуясь дают темно-окрашенные соединения. Поэтому, цвет виноградного сусла из зеленоватого, при контакте с воздухом, становится бурым, коричневым. Действие окислительного фермента хорошо инактивирует сернистая кислота, а вносимый одновременно бентонит удаляет полифенолоксидазу. Локализуется фермент П. Ф.О. на твердых частях ягоды винограда, поэтому сокращают контакт сусла с мезгой, отбирают только сусло – самотек. Прессовые фракции содержат значительно больше этого фермента, поэтому их обрабатывают отдельно.
Пероксидаза . Второй по значимости окислительно-восстановительный фермент винограда. Катализирует реакции окисления фенолов окисления и ароматических аминов в присутствии перекиси водорода по схеме:
АН2 + Н2О2 → А + 2 Н2О,
Где АН2 – восстановленное, А – окисленное соединение.
В результате реакции исходное соединение окисляется с образованием воды. Фермент более активен в кожице, мякоти и гребнях.
Принципы иноктивации пероксидазы те же, что и полифенолоксидазы.
Аскорбинатоксидаза. Катализирует реакцию окисления аскорбиновой кислоты (витамин С) в дегидроаскорбиновую.

(витаминным действием не обладает) Аскорбиновая кислота (витамин С) Дегидроаскорбиновая кислота
В процессе созревания ягод активность этого фермента уменьшается; в зрелых ягодах он слабо активен.
При брожении сусла снижается активность всех окислительных ферментов. По данным А. К. Родопуло инактивация связана с выделением дрожжами сульфгидрильных соединений: цистеина и глютатиона.
К оксидоредуктазам относятся также дегидрогеназы и прежде всего Алькогольдегидрогеназа. Наиболее известны при этом взаимопревращения уксусного альдегида и этанола:
 С2Н5ОН СН3С
С2Н5ОН СН3С
К дегидрогеназам относят еще пять окислительных ферментов: Малат-дегидрогеназа, лактат-дегидрогеназа, сукцинат- дегидрогеназа, алонин-дегидрогеназа, глютатион-дегидрогеназа.
Принцип действия этих ферментов одинаковый: они обеспечивают дегидрированные или присоединенные кислороды, что, по сути дела, одно и то же.
При этом, например, яблочная кислота превращается  :
:

Молочная кислота окисляется до пировиноградной кислоты, а яблочная кислота, с помощью суцинат – дегидрогеназы, превращается в фумаровую кислоту.
Аминокислоты, с помощью соответствующих дегидрогеназ, окисляются до соответствующих органических кислот выделением NH3. Например, глютаминовая кислота окисляется до α – кетоглютаровой органической кислоты:

Дегидрогеназы активны в дрожжевых клетках; они участвуют в процессах при выдержке вина на дрожжевых осадках.
Особую роль в процессах виноделия играют Гидролазы. Они катализируют гидролиз (расщепление) сахарозы, белков, пептидов и других высокомолекулярных соединений.
Их называют по современной номенклатуре: Фруктофуранозидазы, пептидогидролазы, протеолитические, пектолитические ферменты.
Рассмотрим их более подробно.
ß – Фруктофуранозидаза (Инвертаза). Катализирует гидролиз сахарозы на глюкозу и фруктозу, по схеме:
Сахароза + Н2О → глюкоза + фруктоза
Фермент имеет большое значение при брожении, т. к. расщепляет сахарозу.
ß – фруктофуранозидаза содержится в ягодах. Особенно она активна в дрожжах. По данным академика А. И. Опарина этот фермент обладает трансферазивной активностью, т. е. катализирует реакции переноса определенной группы от своих субстратов.
Источники:
http://vinograd.info/knigi/teoriya-i-praktika-vinodeliya/prevrascheniya-v-vinograde-2.html
http://vinograd.info/knigi/teoriya-i-praktika-vinodeliya/prevrascheniya-v-vinograde-12.html
http://vinograd-vino.ru/sostav-vinograda-i-vina/196-fermenty-gruppy-oksidoreduktaz.html




