Перекисная теория окисления – Теория окислительно-восстановительных процессов
Перекисная теория окисления – Теория окислительно-восстановительных процессов
Теория окислительно-восстановительных реакций
Все химические реакции можно разделить на два типа. К первому из них относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ. Например:
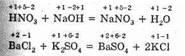
Как видно, степень окисления каждого из атомов до и после реакции осталась без изменения.
Ко второму типу относятся реакции, идущие с изменением степени окисления атомов реагирующих веществ. Например:
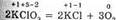
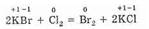
Здесь в первой реакции атомы хлора и кислорода, а во второй — атомы брома и хлора изменяют степень окисления.

Изменение степени окисления связано с оттягиванием или перемещением электронов.
Окислительно-восстановительные реакции — самые распространенные и играют большую роль в природе и технике. Они являются основой жизнедеятельности. С ними связаны дыхание и обмен веществ в живых организмах, гниение и брожение, фотосинтез в зеленых частях растений. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов и при электролизе. Они лежат в основе металлургических процессов и круговорота элементов в природе. С их помощью получают аммиак, щелочи, азотную, соляную и серную кислоты и многие другие ценные продукты. Благодаря окислительно-восстановительным реакциям происходит превращение химической энергии в электрическую — в гальванических элементах и аккумуляторах. Они же лежат в основе мероприятий по охране природы. Поэтому эти реакции преобладают и в школьном курсе неорганической химии.
Рассмотрим основные положения теории окислительно-восстановительных реакций.
1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом. Например:
Аl-3е – =Аl 3+ Н2-2е – =2Н + Fe 2+ -e – =Fe 3+ 2Сl – -2е – =Сl2 При окислении степень окисления повышается.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. Например:
S+2e – =S 2- Сl2+2е – =2Сl – Fe 3+ +e – =Fe 2+ При восстановлении степень окисления понижается.
3. Атомы, молекулы или ионы, отдающие электроны, называются восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются. Так как атомы, молекулы и ионы входят в состав определенных веществ, то и эти вещества соответственно называются восстановителями или окислителями.
4. Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда связано с окислением, что можно выразить уравнением:
Восстановитель – е – «Окислитель Окислитель +е – « Восстановитель
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления и восстановления.

При этом, независимо от того, переходят ли электроны с одного атома на другой полностью или же лишь частично оттягиваются к одному из атомов, условно говорят только об отдаче и присоединении электронов.
, Процессы окисления и восстановления можно физически отделить друг от друга и осуществить перенос электронов по внешней электрической цепи. Пусть в один стакан налит раствор иодида калия KI, а в другой — раствор хлорида железа (III) FeCl3. Растворы соединены между собой так называемым «электрическим ключом» — U-образной трубкой, заполненной раствором хлорида калия КСl, обеспечивающим ионную проводимость.
В растворы опущены платиновые электроды. Если замкнуть цепь, включив в нее чувствительный амперметр, то по отклонению стрелки можно будет наблюдать прохождение электрического тока и его направление. Электроны перемещаются от электрода с раствором иодида калия к электроду с раствором хлорида железа (III), т.е. от восстановителя — ионов I – — к окислителю — ионам Ре 3+ . При этом ионы I – окисляются до молекулы иода I2, а ионы Fe 3+ восстанавливаются до ионов железа (II) Fe 2+ . Через некоторое время продукты реакций можно обнаружить характерными реакциями: иод — раствором крахмала, а ионы Fe 2+ — раствором гексациано-(III)феррата калия (красной кровяной соли) K3[Fe(CN)6].
Описанная схема представляет собой гальванический элемент, построенный на основе окислительно-восстановительной реакции. Он состоит из двух полуэлементов: в первом протекает процесс окисления восстановителя:
2I – -2е – =I2, а во втором — процесс восстановления окислителя:
Поскольку эти процессы протекают одновременно, то, умножив последнее уравнение на коэффициент 2 (для уравнивания числа отданных и присоединенных электронов) и суммируя почленно приведенные уравнения, получим уравнение реакции:
Всякая окислительно-восстановительная реакция может служить источником электрического тока, если она протекает в гальваническом элементе.
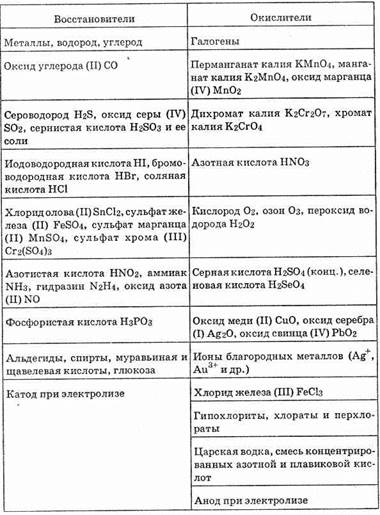
Важнейшие восстановители и окислители
Восстановители и окислители могут быть как простыми веществами, т. е, состоящими из одного элемента, так и сложными.
В соответствии с их местом в периодической системе элементов атомы большинства металлов содержат на внешнем энергетическом уровне 1-2 электрона. Поэтому в химических реакциях они отдают валентные электроны, т.е. окисляются. Металлы обладают восстановительными свойствами.
В периодах с повышением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные возрастают и становятся максимальными у галогенов. Так, например, в третьем периоде натрий — самый активный в периоде восстановитель, а хлор — самый активный в периоде окислитель.
У элементов главных подгрупп с повышением порядкового номера усиливаются восстановительные свойства и ослабевают окислительные. Лучшие восстановители — щелочные металлы, а наиболее активные из них Fr и Cs. Лучшие окислители— галогены. Элементы главных подгрупп IV-VII групп (неметаллы) могут как отдавать, так и принимать электроны и проявлять восстановительные и окислительные свойства. Исключение составляет фтор. Он проявляет только окислительные свойства, так как обладает наибольшей относительной электроотрицательностью.
Элементы побочных подгрупп (четных рядов) больших периодов имеют металлический характер, так как на внешнем уровне
их атомов содержится 1-2 электрона. Поэтому их простые вещества являются восстановителями. В отличие от простых веществ металлов, выступающих в роли восстановителей, простые вещества неметаллы проявляют себя и как окислители, и как восстановители.
Окислительные или восстановительные свойства сложных веществ зависят от степени окисления атома данного элемента. Например, KMn +7 O4, Mn +4 O2, Mn +2 SO4. В первом соединении марганец имеет максимальную степень окисления и не может ее больше повышать. Он может только принимать электроны, а значит, KMnO4 может быть только окислителем. В третьем соединении у марганца низшая степень окисления — оно может быть только восстановителем. Во втором соединении марганец с промежуточной степенью окисления (+4), а потому оно может быть и восстановителем, и окислителем; все зависит от условий протекания реакции и веществ, с которыми будет взаимодействовать MnO2. Сложные анионы, содержащие атомы с высокой степенью
окисления, также являются окислителями. Например, N +5 O – 3,
Mn +7 O – 4, Cr +6 2O 2- 7, Cl +5 O – 3, Сl +7 О – 4 и др. Окислительные свойства обусловливает не атом с высокой степенью окисления, а весь анион, например, не Mn +7 , а весь анион MnO – 4. Элементарные анионы проявляют только восстановительные свойства. Например, F – , Сl – , Br – ,I – ,S 2- и др.
Важнейшие окислители и восстановители приведены в таблице 8.
Составление уравнений окислительно-восстановительных
Применяются два метода составления уравнений окислительно-восстановительных реакций — метод электронного баланса и метод полуреакций.
Метод электронного баланса. В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основании известных свойств элементов. Рассмотрим применение этого метода на примерах.
Важнейшие восстановители и окислители
Пример 1.Составление уравнения реакции меди с раствором нитрата палладия (II). Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления:
Медь, образуя ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2. Медь — восстановитель. Ион палладия, присоединяя два электрона, изменяет степень окисления от +2 до 0. Нитрат палладия (II) — окислитель. Эти изменения можно выразить электронными уравнениями
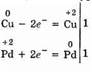
из которых следует, что при восстановлении и окислении коэффициенты равны 1.Окончательное уравнение реакции: Cu+Pd(NO3)2=Cu(NO3)2+Pd
Как видно, в суммарном уравнении реакции электроны не фигурируют.
Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в его правой и левой частях. Например, в правой части 6 атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
Cu+Pd 2+ +2NO3=Cu 2+ +2NO – 3+Pd И после сокращения одинаковых ионов получим:
Пример 2.Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой (с помощью этой реакции в лабораторных условиях получают хлор).
Запишем формулы исходных и конечных веществ реакции:
Покажем изменение степеней окисления атомов до и после реакции:
Это реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и марганца. НС1 — восстановитель, MnO2 — окислитель. Составляем электронные уравнения:
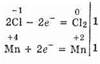
и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления -1 Отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении:
Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моля НС1 приходится 1 моль MnO2. Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моля кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моля. Окончательное уравнение имеет вид: 4НСl+MnO2=Сl2+MnСl2+2Н2O
Проверку правильности написания уравнения можно ограничить подсчетом числа атомов какого-либо элемента, например хлора: в левой части 4 и в правой 2 + 2 = 4.
Поскольку в методе электронного баланса изображаются уравнения реакций в молекулярной форме, то после составления и проверки их следует написать в ионной форме. Перепишем составленное уравнение в ионной форме:
и после сокращения одинаковых ионов в обеих частях (они подчеркнуты) получим:
Пример 3. Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия.
Напишем схему реакции — формулы исходных и полученных веществ:
Затем Покажем изменение степеней окисления атомов до и после реакции:
H2S -2 +KMn +7 O4+H2SO4®S 0 +Mn +2 SO4+K2SO4+Н2О Изменяются степени окисления у атомов серы и марганца (H2S — восстановитель, KMnO4 — окислитель). Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
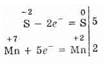
И наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 молей H2S и 2 моля KMnO4, тогда получим 5 молей атомов S и 2 моля MnSO4. Кроме того, из сопоставления атомов в левой и правой частях уравнения . найдем, что образуется также 1 моль K2SO4 и 8 молей воды.
Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода: в левой части их 2• 4+3•4=20 и в правой части 2•4+4+8=20.
Переписываем уравнение в ионной форме:
Известно, что правильно написанное уравнение реакции является выражением закона сохранения массы вещества. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.
Дата добавления: 2016-01-03 ; просмотров: 1135 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Перекисная теория окисления – Теория окислительно-восстановительных процессов

 ;
;
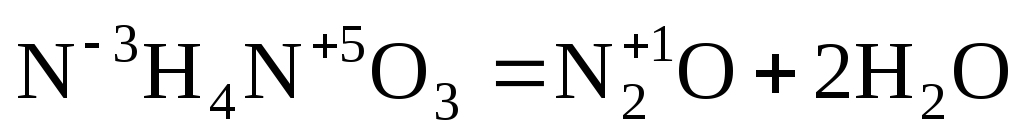 .
.
Реакции диспропорционирования можно рассматривать как разновидность реакции внутримолекулярного окисления-восстановления.
Если в исходном веществе атомы элемента находятся в одной степени окисления, а в продуктах реакции – в двух других (более высокой и более низкой по отношению к исходной степени, окисления), то соответствующие ОВР относятся к реакциям диспропорционирования, например:
 .
.
Методы расстановки коэффициентов в уравнениях овр
Подбор коэффициентов в ОВР осуществляется в соответствии с правилом: количество электронов, отданных восстановителем, должно быть равно количеству электронов, полученных окислителем. На этом правиле основаны 2 метода расстановки коэффициентов: метод учета изменения степеней окисления (метод электронного баланса) и ионно-электронный метод (метод полуреакций).
1. Расстановка коэффициентов
методом электронного баланса (МЭБ)
Последовательность действий при использовании МЭБ следующая:
выделяем атомы, элементы которых в исходных веществах и продуктах реакции изменяют степень окисления,
составляем электронный баланс присоединения и отдачи электронов, по исходным веществам (для ОВР межмолекулярного гида), или по конечным продуктам (для ОВР внутримолекулярного типа и реакций диспропорционирования);
находим коэффициенты, которые нужно поставить перед формулами веществ, где атомы изменили степень окисления. Для этого сначала находим наименьшее общее кратное для чисел отданных и присоединенных электронов. Соответствующие коэффициенты определяем путем деления наименьшего общего кратного на эти числа;
расставляем найденные коэффициенты сначала перед формулами веществ, в которых атомы изменили степень окисления, а затем перед формулами оставшихся веществ;
проверяем правильность нахождения коэффициентов. Обычно это делают по кислороду.
Рассмотрим примеры расстановки коэффициентов в уравнениях ОВР по МЭБ.
Пример 1. Расставьте коэффициенты в схеме ОВР:
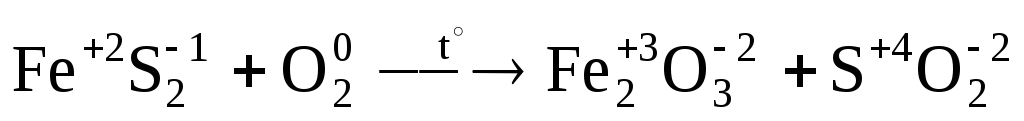
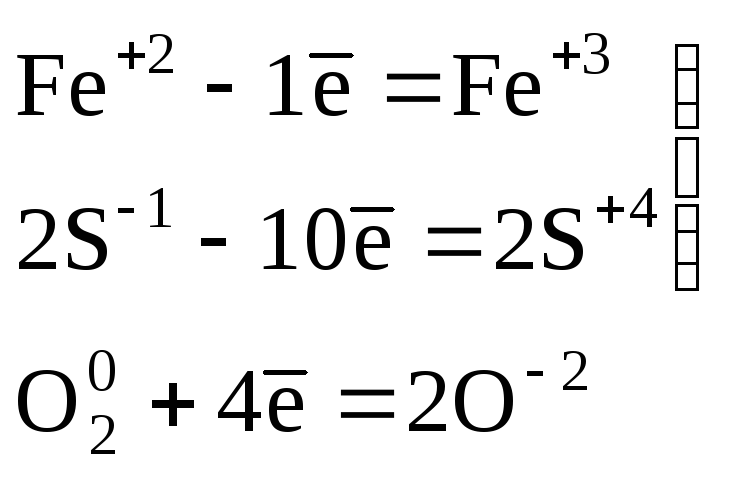



Конечное уравнение этой реакции:
4FeS2 +11О2  2Fe2O3+8SO2.
2Fe2O3+8SO2.
Пример 2. Расставьте коэффициенты в схеме ОВР:
 .
.
Марганец в КМnO4 находится в высшей степени окисления (+7), значит, КМnO4 – окислитель. Продукты его восстановления зависят от кислотности среды, что можно показать схемой:
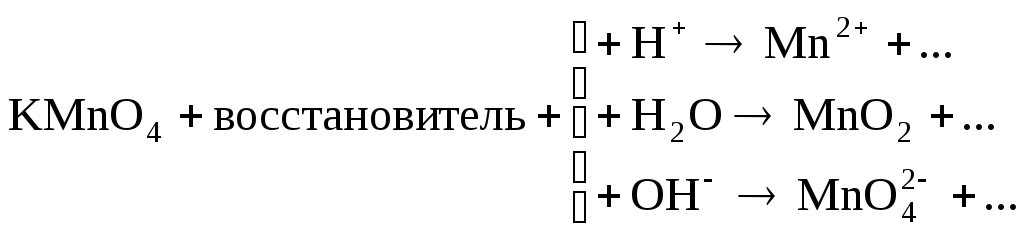 .
.
В данном примере реакция идет в кислой среде, значит, продукт восстановления перманганата калия – ион Мn 2+ . Восстановителем будет ион Fe 2+ , который окисляется до Fe 3+ :
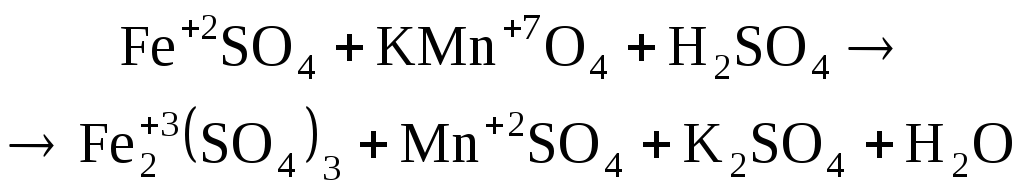
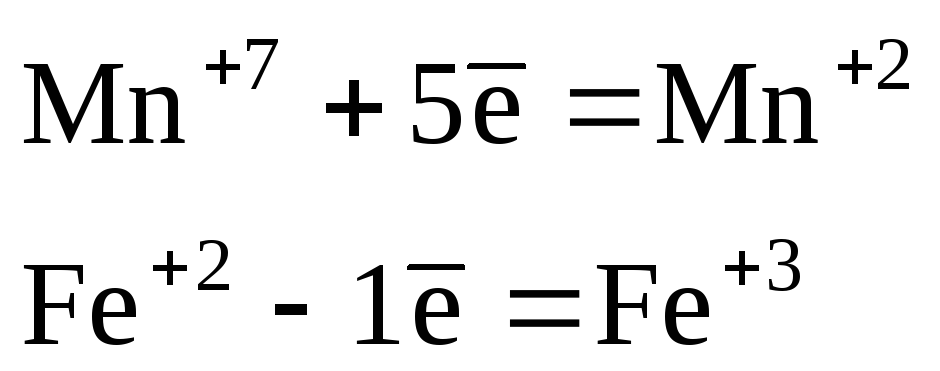

 .
.
Основными коэффициентами уравнения будут 1 и 5, но в результате реакции образуется соль Fe2(SO4)3, которая содержит два иона Fe (III), поэтому основные коэффициенты нужно удвоить. Подставляем эти коэффициенты сначала в левую, а потом в правую часть схемы реакция, далее подбираем остальные коэффициенты:
 .
.
Пример 3. Расставьте коэффициенты в схеме ОВР:
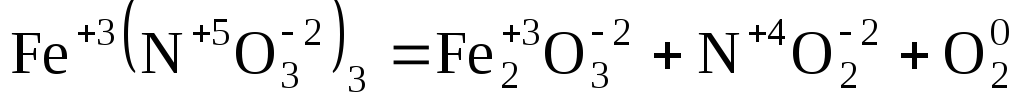 .
.
Данная реакция относится к реакциям внутримолекулярного окисления-восстановления.
Определяем элементы, атомы которых изменили степень окисления. В данном случае это азот и кислород.
Записываем электронные уравнения процессов окисления и восстановления:
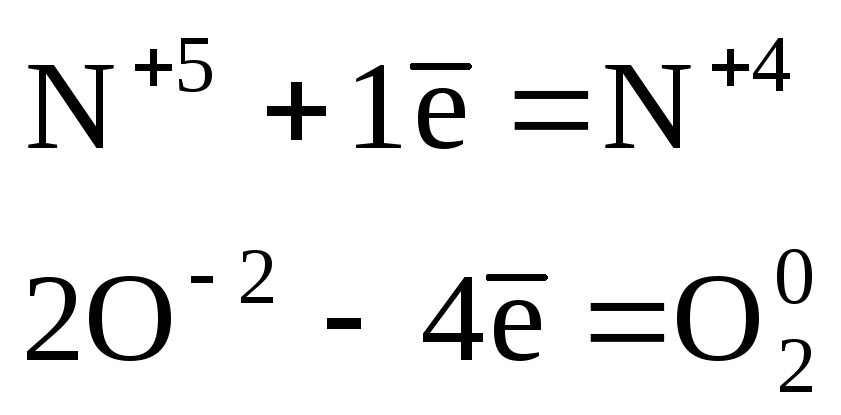
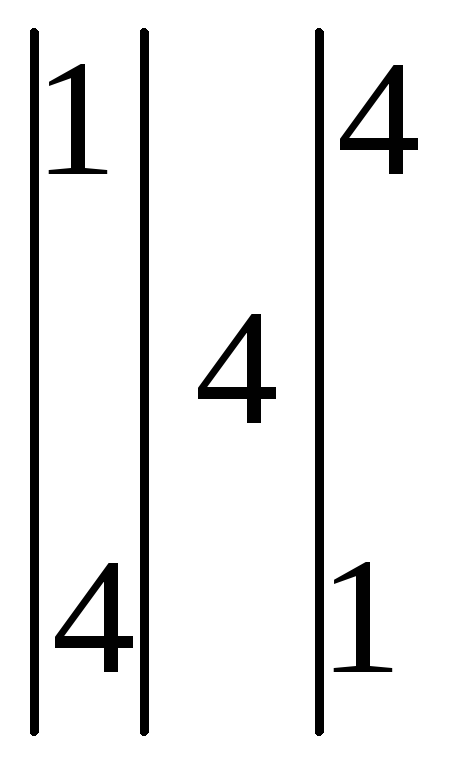
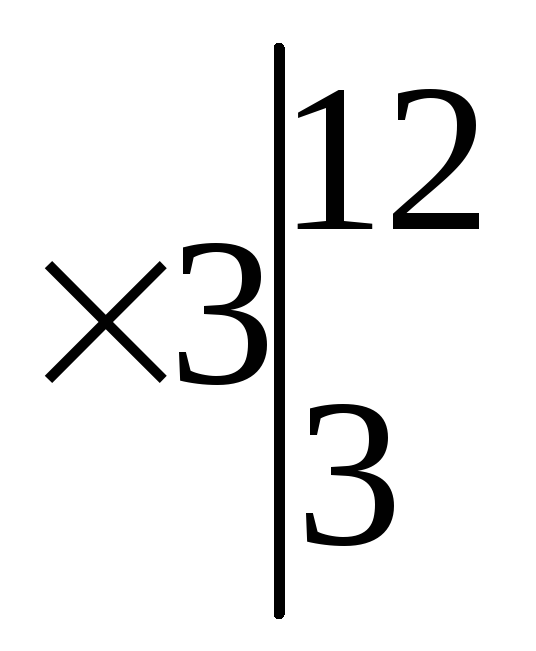
Основными коэффициентами уравнения будут (1) и (4), но вступает в реакцию соль Fe(NО3)3, которая содержит три атома N +5 , поэтому основные коэффициенты нужно утроить. Подставляем эти коэффициенты (12) и (3) сначала в левую часть.
Конечное уравнение этой реакции:
 .
.
Пример 4. Расставьте коэффициенты в схемах ОВР с участием пероксида водорода.
В молекуле Н2О2 атомы кислорода имеют степень окисления (–1), которая является промежуточной между наиболее характерными для кислорода значениями (–2) и (0). Поэтому пероксид водорода в разных условиях может быть как окислителем, так и восстановителем.
Уравнения соответствующих реакций окисления-восстановления с участием Н2О2 записываем так:
Н2О2-окислитель 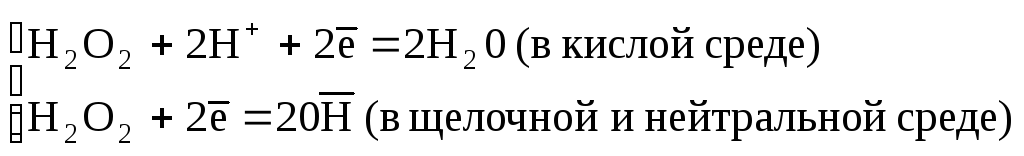
Н2О2-восстановитель 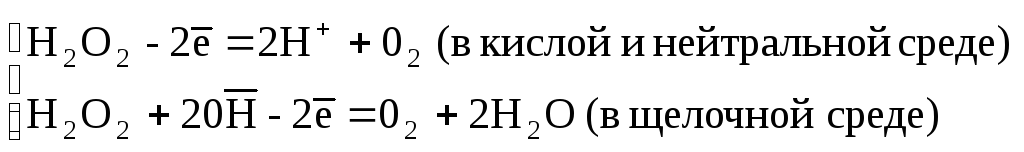
Теория окислительно-восстановительных реакций
Все химические реакции можно разделить на два типа . К первому из них относятся реакции , протекающие без изменения степени окисления атомов , входящих в состав реагирующих веществ .
 =
= 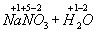
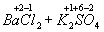 =
= 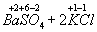
Как видно , степень окисления каждого из атомов до и после реакции осталась без изменения .
Ко второму типу относятся реакции, идущие с изменением степени окисления атомов реагирующих веществ.
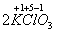 =
= 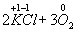
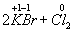 =
= 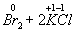
Здесь в первой реакции атомы хлора и кислорода , а во второй — атомы брома и хлора изменяют степень окисления .
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными .
Изменение степени окисления связано с оттягиванием или перемещением электронов .
Окислительно — восстановительные реакции — самые распространен ные и играют большую роль в природе и технике .
Рассмотрим основные положения теории окислительно — восстанови тельных реакций .
1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом .
Al – 3e — = Al 3+ Fe 2+ — e — = Fe 3+
H2 – 2e — = 2H + 2Cl — — 2e — = Cl2
При окислении степень окисления повышается .
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом.
S + 2 е — = S 2- С l2 + 2 е — = 2 С l — Fe 3+ + e- = Fe 2+
При восстановлении степень окисления понижается .
3. Атомы , молекулы или ионы , отдающие электроны называются восстановителями . Во время реакции они окисляются . Атомы , молекулы или ионы , присоединяющие электроны , называются окислителями . Во время реакции они восстанавливаются . Так как атомы , молекулы и ионы входят в состав определенных веществ , то и эти вещества соответственно называются восстановителями или окислителями .
4. Окисление всегда сопровождается восстановлением , и наоборот , восстановление всегда связано с окислением , что можно выразить уравнениями :
Восстановитель – е — 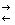 Окислитель
Окислитель
Окислитель + е —  Восстановитель
Восстановитель
Поэтому окислительно — восстановительные реакции представляют собой единство двух противоположных процессов — окисления и восстановления .
Число электронов , отдаваемых восстановителем , равно числу электронов , присоединяемых окислителем .
При этом , независимо от того , переходят ли электроны с одного атома на другой полностью или же лишь частично оттягиваются к одному из атомов , условно говорят только об отдаче и присоединении электронов .
Процессы окисления и восстановления можно физически отделить друг от друга и осуществить перенос электронов по внешней электрической цепи . Пусть в стакан 2 налит раствор иодида калия К I 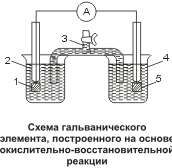 , а в стакан 4 — раствор хлорида железа ( III ) Fe С l 3 . Растворы соединены между собой так называемым « электролитическим ключом» 3 – U -образной трубкой , заполнен ной раствором хлорида калия К Cl , обеспечивающим ионную проводимость . В растворы опущены платиновые электроды 1 и 5. Если замкнуть цепь , включив в нее чувствительный амперметр , то по отклонению стрелки можно будет наблюдать прохождение электрического тока и его направление . Электроны перемещаются от электрода с раствором иодида калия к электроду с раствором хлорида железа ( III ), т . е . от восстановителя — ионов I — — к окислителю – ионам Fe 3+ . При этом ионы I — окисляются до молекул иода I 2 , а ионы F е 3+ восстанавливаются до ионов железа ( II ) Fe 2+ . Через некоторое время продукты реакций можно обнаружить характерными реакциями : иод — раствором крахмала , а ионы Fe 2+ — раствором гексациано -( II ) феррата калия ( красной кровяной соли ) К 3 [ F е ( С N ) 6 ].
, а в стакан 4 — раствор хлорида железа ( III ) Fe С l 3 . Растворы соединены между собой так называемым « электролитическим ключом» 3 – U -образной трубкой , заполнен ной раствором хлорида калия К Cl , обеспечивающим ионную проводимость . В растворы опущены платиновые электроды 1 и 5. Если замкнуть цепь , включив в нее чувствительный амперметр , то по отклонению стрелки можно будет наблюдать прохождение электрического тока и его направление . Электроны перемещаются от электрода с раствором иодида калия к электроду с раствором хлорида железа ( III ), т . е . от восстановителя — ионов I — — к окислителю – ионам Fe 3+ . При этом ионы I — окисляются до молекул иода I 2 , а ионы F е 3+ восстанавливаются до ионов железа ( II ) Fe 2+ . Через некоторое время продукты реакций можно обнаружить характерными реакциями : иод — раствором крахмала , а ионы Fe 2+ — раствором гексациано -( II ) феррата калия ( красной кровяной соли ) К 3 [ F е ( С N ) 6 ].
Приведенная на рис унке схема представляет собой гальванический элемент , построенный на основе окислительно — восстановительной реакции . Он состоит из двух полуэлементов : в первом протекает процесс окисления восстановителя :
2 I — — 2 e — = I 2
а во втором — процесс восстановления окислителя :
Поскольку эти процессы протекают одновременно , то , умножив последнее уравнение на коэффициент 2 ( для уравнивания числа отданных и присоединенных электронов ) и суммируя почленно приведенные уравнения , получим уравнение реакции :
2I — + 2Fe 3+ = I2 + 2Fe 2+
Всякая окислительно — восстановительная реакция может служить источником электрического тока , если она протекает в гальваническом элементе .
Важнейшие восстановители и окислители
Источники:
http://helpiks.org/6-36954.html
http://studfile.net/preview/5240237/page:10/
http://www.himhelp.ru/section23/section7/section43/




