Оксидаза диоксифумаровой кислоты – Ферменты
Оксидаза диоксифумаровой кислоты – Ферменты
Оксидоредуктазы
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
Современная классификация ферментов разработана Международным биохимическим союзом (1961г.). В ее основу положен тип катализируемой реакции и механизм. Все ферменты делят на шесть классов: I. Оксидоредуктазы. II. Трансферазы. III. Гидролазы. IV. Лиазы. V. Изомеразы. VI. Лигазы.
Каждый фермент имеет кодовый номер по классификации ферментов: первая цифра характеризует класс реакции, вторая − подкласс, третья − подподкласс, четвертая цифра указывает порядковый номер фермента в его подподклассе. Название фермента состоит из двух частей: в первой части − название субстрата (или субстратов), во второй − тип катализируемой реакции.
Оксидоредуктазы
Оксидоредуктазы катализируют окислительно-восстановительные реакции и подразделяются на 5 основных подклассов:
Оксидазы. Катализируют удаление водорода из субстрата, используя при этом в качестве акцептора водорода только кислород. Оксидазы содержат медь, продуктом реакции является вода (исключение составляют реакции, катализируемые уриказой и моноаминоксидазой, в результате которых образуется Н2О2).
Общая схема процесса следующая:
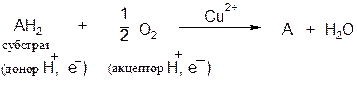
В качестве субстратов оксидаз могут выступать фенолы, полифенолы, амины. Примерами ферментов класса оксидаз являются фенолаза, цитохром-оксидаза, моноаминоксидаза, уриказа.
Фенолаза (катехолоксидаза, тирозиназа) − медьсодержащий фермент с широкой специфичностью. Он катализирует превращение монофенола
(в присутствии о-дифенола) в орто-хинон. Медь содержится также в уриказе, катализирующей окисление мочевой кислоты в аллантоин, и в моноаминоксидазе, окисляющей адреналин и тирамин в митохондриях.
Цитохромоксидаза − гемопротеин, который служит конечным компонентом дыхательной цепи и осуществляет перенос электронов на конечный акцептор − кислород. Данный фермент ингибируется оксидом углерода (II), цианидами и сероводородом. Фермент содержит две молекулы гема, в каждой из которых атом железа может переходить из состояния Fe 2+ в состояние Fe 3+ и обратно в ходе окисления и восстановления, а также два атома Сu, каждый из которых взаимодействует с одним из гемов.
Аэробные дегидрогеназы. Катализируют удаление водорода из суб-страта, используя в качестве акцептора водорода не только кислород, но и искусственные акцепторы (например, метиленовый синий). Эти дегидрогеназы относятся к флавопротеинам.
В результате реакции образуется пероксид водорода, а не вода:
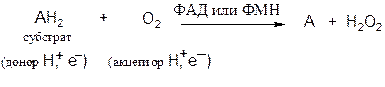
В качестве кофермента дегидрогеназы содержат ФАД (флавинаденин-динуклеотид) или ФМН (флавинмононуклеотид). Многие флавопротеиновые ферменты содержат несколько ионов металлов.
К ферментам группы аэробных дегидрогеназ относятся: дегидрогеназа L-аминокислот (оксидаза L-аминокислот), катализирующая окислительное дезаминирование природных L-аминокислот, и ксантиндегидрогеназа (ксантиноксидаза), катализирующая окисление ксантина в мочевую кислоту. Молибденсодержащий фермент ксантиноксидаза играет важную роль в катаболизме пуриновых оснований.
Анаэробные дегидрогеназы. Катализируют удаление водорода из субстрата, но не способны использовать кислород в качестве акцептора.
Общая схема процесса следующая:
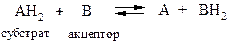
Анаэробные дегидрогеназы подразделяются в зависимости от природы кофермента на несколько групп.
НАД + -зависимые (пиридинзависимые, первичные) дегидрогеназы, содержащие в качестве кофермента НАД + или НАДФ + . В общем случае НАД + -зависимые дегидрогеназы катализируют окислительно-восстановительные реакции специфических (например, гликолиза) и общих путей катаболизма (например, цикла Кребса, дыхательной цепи).
Общая схема процесса следующая:
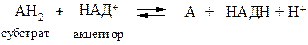
Примером НАД + -зависимых дегидрогеназ могут служить лактатдегидрогеназа, алкогольдегидрогеназа, глутаматдегидрогеназа и др. Например, 1.1.1.27 L-лактат: НАД + -оксидоредуктаза (лактатдегидрогеназа) катализирует взаимопревращение лактата и пирувата:

Пируват L – Лактат
ФАД- и ФМН- зависимые анаэробные дегидрогеназы (флавин-зависимые дегидрогеназы). Первичные флавинзависимые дегидрогеназы переносят восстановительные эквиваленты от субстрата непосредственно на дыхательную цепь. К ним относятся, например, 1.3.99.1 сукцинатдегидрогеназа (СДГ), ацил-КоА-дегидрогеназа и митохондриальная глицерол-3-фосфат-дегидрогеназа:
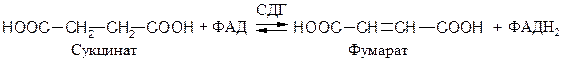
Вторичная ФМН-зависимая НАДН-дегидрогеназа − компонент дыхательной цепи, переносящий электроны от НАДН к более электроположительным компонентам:
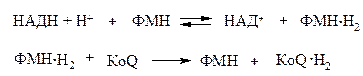
Еще одна функция флавинзависимых дегидрогеназ − катализируемое дигидролипоилдегидрогеназой дегидрирование восстановленного липоата
(промежуточного продукта при окислительном декарбоксилировании пирувата и a-кетоглутарата). При этом вследствие низкого значения окислительно-восстановительного потенциала системы липоата переносчиком водорода от восстановленного липоата к НАД + является флавопротеин (ФАД).
Цитохромы за исключением цитохромоксидазы классифицируются как анаэробные дегидрогеназы. В дыхательной цепи они служат переносчиками электронов от флавопротеинов к цитохромоксидазе. Цитохромы являются гемопротеинами, у которых атом железа переходит из состояния Fe 2+ в Fe 3+ и обратно в процессе окисления и восстановления. Помимо дыхательной цепи цитохромы имеются в эндоплазматическом ретикулуме (цитохромы Р-450 и b-5).
Гидропероксидазы. К их числу относятся ферменты пероксидаза и каталаза.
Пероксидаза − фермент, катализирующий окисление пероксидом водорода различных органических соединений − фенолов, аминов, аскорбиновой кислоты, цитохрома С. Пероксидаза обнаружена в растениях, молоке, лейкоцитах, тромбоцитах, а также в тканях, в которых происходит метаболизм эйкозаноидов. Фермент содержит протогем, который в отличие от гемовых групп большинства гемопротеинов слабо связан с апоферментом.
Реакция, катализируемая пероксидазой, имеет сложный характер; суммарная реакция выглядит следующим образом:
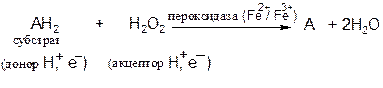
В эритроцитах глутатионпероксидаза, содержащая в качестве простетической группы селен, катализирует разложение Н2О2 и гидропероксидов липидов восстановленным глутатионом и, таким образом, защищает липиды мембран и гемоглобин от окисления пероксидами.
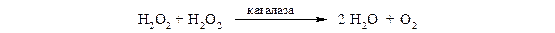
Каталаза − это гемопротеин, содержащий 4 гемовые группы. Наряду с пероксидазной активностью каталаза способна использовать одну молекулу Н2О2 в качестве донора электронов, а другую − в качестве акцептора электронов. В организме каталаза в основном разлагает пероксид водорода, образующийся при действии аэробных дегидрогеназ:
Каталаза содержится в крови, костном мозге, мембранах слизистых оболочек, почках и печени.
Во многих тканях, включая и печень, обнаружены микротельца − пероксисомы, которые богаты аэробными дегидрогеназами и каталазой. Биологически выгодно группировать в одном месте как ферменты, приводящие к образованию Н2О2, так и ферменты, разлагающие это соединение.
К ферментам, катализирующим образование Н2О2, кроме пероксисомных ферментов, относятся также митохондриальные и микросомные системы транспорта электронов.
Оксигеназы.
Ферменты этой группы катализируют включение кисло-рода в молекулу субстрата, которое происходит в две стадии:
1) кислород связывается с активным центром фермента;
2) происходит реакция, в результате которой, связанный кислород восстанавливается или переносится на субстрат.
Оксигеназы не относятся к ферментам, которые катализируют реакции, снабжающие клетку энергией; они участвуют в синтезе и деградации многих типов метаболитов, токсинов и ксенобиотиков. Оксигеназы подразделяются на 2 подгруппы.
Монооксигеназы (гидроксилазы). Эти ферменты катализируют включение в субстрат только одного из атомов молекулы кислорода. Другой атом кислорода восстанавливается до воды; для чего необходим дополнительный донор электронов (косубстрат):
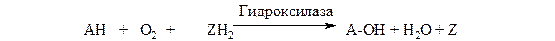
Природа косубстрата может быть различной. Многие оксигеназы используют НАДФН2. В этом случае суммарное уравнение реакции можно записать как
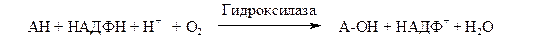 К подобным системам относятся микросомные цитохром-Р-450-содержащие монооксигеназные системы, участвующие в метаболизме многих лекарственных веществ путем их гидроксилирования. Они находятся в микросомах печени вместе с цитохромом Р-450 и цитохромом b-5. Восстановителями этих цитохромов являются НАДН и НАДФН. Цитохромы окисляются субстратами в результате серии ферментативных реакций, составляющих так называемый гидроксилазный цикл:
К подобным системам относятся микросомные цитохром-Р-450-содержащие монооксигеназные системы, участвующие в метаболизме многих лекарственных веществ путем их гидроксилирования. Они находятся в микросомах печени вместе с цитохромом Р-450 и цитохромом b-5. Восстановителями этих цитохромов являются НАДН и НАДФН. Цитохромы окисляются субстратами в результате серии ферментативных реакций, составляющих так называемый гидроксилазный цикл:
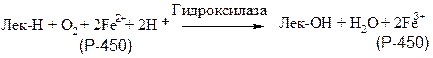
Лек – лекарственное вещество
К лекарственным веществам, метаболизм которых идет при участии рассматриваемых систем, относятся, например, морфин и бензпирен. Многие лекарственные вещества (например, фенобарбитал) способны индуцировать синтез микросомных ферментов и цитохрома Р-450. Цитохром Р-450 является одновременно гемо- и флавопротеином, причем флавиновые нуклеотиды выступают в качестве второго донора электронов. Цитохром Р-450 в печени осуществляет гидроксилирование липофильных соединений, образующихся в качестве побочных продуктов или попадающих в организм извне (такие вещества объединяют под общим названием «ксенобиотики»). Введение в их молекулы гидроксильных групп повышает гидрофильность этих веществ, понижает токсичность и облегчает их вывод из организма.
Другой пример подобных систем − митохондриальные цитохром-Р-450-содержащие монооксигеназные системы. Они находятся в коре надпочечников, семенниках, яичниках, плаценте, почках и участвуют в биосинтезе стероидных гормонов из холестерина, катализируют гидроксилирование гидроксихолекальциферола, что приводит к образованию активной формы витамина D3 (1,25-дигидроксихолекальциферола). В коре надпочечников содержание митохондриального цитохрома Р-450 в 6 раз выше, чем содержание цитохромов в дыхательной цепи.
Диоксигеназы (истинные оксигеназы). Эти ферменты катализируют включение в молекулу субстрата обоих атомов молекулы кислорода:

Примером служат железосодержащие ферменты 1.13.11.5 гомогентизатдиоксигеназа и 1.13.11.6 3-гидроксиантранилатдиоксигеназа, а также некоторые гемсодержащие ферменты, в частности триптофандиоксигеназа (триптофанпирролаза).
77.243.189.108 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Вопрос № 3:Ферменты класса оксидоредуктаз. Оксидазы, полифенолоксидазы
Ферменты (энзимы) – это биокатализаторы, образующиеся в клетке и представляющие собой либо простые белки, либо сложные, содержащие неаминокислотные компоненты. Все процессы жизнедеятельности, как пищеварение, дыхание и т.д. осуществляются при помощи ферментов. Ферменты ускоряют биологические реакции, снижая энергию активации и не изменяя положения равновесия. Существует несколько типов окислительно-восстановительных ферментативных реакций. Ферменты этого типа переносят водород или электроны и катализируют биологическое окисление. В их состав входят специфические коферменты. Такие ферменты называют оксидоредуктазы.

Они подразделяются в соответствии с донором, от которого переносится водород или электрон, или в соответствии с акцептором, к которому идет перенос.
Среди оксидоредуктаз различают дегидрогеназы, оксидазы, пероксидазы. Оксидазы – аэробные дегидрогеназы, передающие водород субстрата непосредственно кислороду. К ним относится полифенолоксидаза катализирующая реакцию окисления полифенолов с образованием темноокрашенных соединений. Действие полифенолоксидазы проявляется в потемнении тканей плодов и овощей, пораженных плесенями. Наличием в растительных клетках полифенолоксидазы объясняется и наблюдаемое потемнение поверхности срезов яблок, клубней картофеля и др. К классу оксидоредуктаз относят и фермент каталазу, осуществляющую расщепление перекиси водорода на воду и молекулярный кислород. Физиологическая роль каталазы состоит, прежде всего, в том, что она предотвращает накопление значительных количеств перекиси водорода, так как последняя ядовита для клеток.

Полифенолоксидаза содержится в высших растениях и в грибах. Массовая доля меди в данном ферменте составляет 0,2-0,3 %. Например, ее молекулярная масса у грибов равна 34500, а у чайного листа – 144000. Полифенолоксидаза участвует в окислении полифенолов и дубильных веществ, ее действием объясняется потемнение плодов и овощей при сушке, потемнение поверхности разрезанных яблок или картофельного клубня.
Окисление органических веществ в клетке осуществляется кислородом. Однако обычный молекулярный кислород О2 химически неактивен; чтобы он смог принимать участие в ОВ-реакциях, его нужно активировать – разорвать молекулу О2 на 2 атома кислорода. В этом и состоит функция оксидаз. Оксидазы, как и денидрогеназы, являются сложными ферментами и состоят из белковой части и простетической группы, которая обязательно содержит металл. По этому признаку выделяют 3 группы оксидаз:
- – железосодержащие; к ним относятся каталаза, пероксидаза и многие белки дыхательной цепи – фитохромы
- – медьсодержащие; к ним относятся полифенолоксидаза и аскорбатоксидаза
- – содержащие и железо, и медь – цитохромоксидаза
Функции оксидаз в клетке очень разнообразны. Цитохромы и цитохромоксидаза входят в состав дыхательной цепи, где принимают участие в активации кислорода и его использовании для окисления водорода дегидрогеназ. Однако многие оксидазы катализируют ОВ-реакции, не связанные с дыханием:
– каталаза разлагает пероксид водорода Н2О2 на воду и кислород:
- – пероксидаза с помощью О2 окисляет сложные органические вещества (например, фенольные соединения)
- – полифенолоксидаза с помощью О2 окисляет полифенолы до хинонов
- – аскорбатоксидаза с помощью О2 окисляет аскорбиновую кислоту до дегидроаскорбиновой
Из этого класса ферментов особо следует выделить дегидрогеназы, катализирующие реакции отщепления водорода от одного вещества и перенос его к другому. Первое вещество в данном случае называется донором водорода, а второе – акцептором его. Дегидрогеназы разделяют на флавиновые и пиридиновые.
Пиридиновые дегидрогеназы. Их называют анаэробными, так как они непосредственно кислороду передавать водород не могут.
Коферментами пиридиновых дегидрогеназ являются никотинамидадениндинуклеотид-фосфат (НАДФ) и никотинамидадениндинуклеотид (НАД). НАД представляет собой динуклеотид, состоящий из азотистого основания аденина, амида никотиновой кислоты (витамина РР), двух молекул сахара рибозы и двух остатков фосфорной кислоты. НАДФ отличается от НАД присутствием третьего остатка фосфорной кислоты. Со своим апоферментом они связаны только в момент осуществления реакции дегидрирования. Одни дегидрогеназы содержат только НАДФ, другие – НАД, т.е. эти коферменты не могут замещать друг друга.
Взаимодействуя с субстратом, дегидрогеназы отнимают от него два иона водорода и два электрона. Способностью обратимо присоединять протоны и электроны обладают их коферменты. Например, НАДФ переходит в восстановленную форму НАДФН2, НАД – в НАДН2. Примерами анаэробных дегидрогеназ являются малатдегидрогеназа, катализирующая превращение яблочной кислоты в щавелевоуксусную, и алкогольдегидрогеназа, превращающая этиловый спирт (этанол) в уксусный альдегид.
Коферментами флавuновых дегидрогенах являются флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН).ФАД и ФМН являются нуклеотидами, содержащими пятиуглеродный спирт D-рибит (рибитол) и азотистое основание рибофлавин (витамин В2), обладающий способностью обратимого при соединения водорода. В составе ФАД находятся два нуклеотида, один из которых содержит остатки D – рибита, фосфорной кислоты и флавина, другой – остатки аденина, рибозы и фосфорной кислоты. Состав ФМН представлен D – рибитом, остатком фосфорной кислоты и флавином. Восстановленная форма ФАД обозначается как ФАД Н2, а ФМН – ФМН Н2. Со своим апоферментом флавиновые коферменты связаны значительно прочнее, чем пиридиновые. Другим отличием флавиновых дегидрогеназ является наличие в составе их апоферментов металлов (железа, марганца, меди, молибдена).

Представителями аэробных дегидрогеназ являются оксидазы, для которых акцептором водорода служит исключительно кислород воздуха. Отщепляя водород от окисляемого вещества АН2 и передавая его кислороду, оксидаза образует воду или перекись водорода. Среди оксидаз в растительном мире широкое распространение получили полифенолоксидаза и аскорбатоксидаза. Обе представлены белком, содержащим в качестве кофермента медь. Первая окисляет дифенолы, вторая превращает аскорбиновую кислоту в дегидроаскорбиновую. Важную роль в жизни растений выполняет цuтохромоксидаза, которая активирует молекулярный кислород, перенося на него электроны от цитохромной системы.
Нельзя не отметить и пероксидазу, осуществляющую окисление органических веществ с помощью перекиси водорода, с которой она образует комплексное соединение и приобретает способность быть акцептором водорода. Пероксидаза широко распространена в мире растений и играет важную роль в превращении полифенолов и ароматических аминов.
Ферменты – Оксидаза диоксифумаровой кислоты
Содержание материала
Диоксифумаровая кислота играет важную роль в биологическом окислении, так как в ее молекуле содержатся две вторичные оксигруппы — СОН = СООН—, которые могут обратимо окисляться и восстанавливаться. Поэтому диоксифумаровая кислота может функционировать в роли переносчика водорода.
Оксидаза диоксифумаровой кислоты катализирует реакцию окисления диоксифумаровой в дикетоянтарную кислоту.
Мы выделили оксидазу диоксифумаровой кислоты из свежего виноградного сока осаждением сульфатом аммония или ацетоном. Затем осажденный фермент диализовали против дистиллированной воды. Активность оксидазы диоксифумаровой кислоты определяли по количеству поглощенного кислорода в респирометрах Варбурга. Результаты анализа приведены в табл. 6.
Таблица 6
АКТИВНОСТЬ ОДСИДАЗЫ ДИОКСИФУМАРОВОЙ КИСЛОТЫ В ВИНОГРАДЕ
Количество O2 (в мкл O2 на 500 мг сухого вещества), поглощенного через
Кипяченый фермент + диоксифумаровая кислота
Фермент + диоксифумаровая кислота
Из данных, приведенных в табл. 6, видно, что один фермент не поглощает кислород. Кипяченый фермент с диоксифумаровой кислотой за 45 мин поглощает 205 мкл кислорода. Примерно столько же кислорода поглощает одна диоксифумаровая кислота без фермента. Эта кислота в водных растворах неустойчива и легко самопроизвольно окисляется.
Система фермент + диоксифумаровая кислота за 45 мин поглощает примерно в 2 раза больше кислорода, чем одна диоксифумаровая кислота. Эти данные свидетельствуют о том, что в винограде содержится оксидаза диоксифумаровой кислоты.
Этот фермент у некоторых растений ингибируется цианидом калия. Однако наши данные противоречат этому. Так, например, оксидаза диоксифумаровой кислоты, выделенная из винограда, не чувствительна к цианиду калия, который не ингибирует этот фермент, а, напротив, стимулирует поглощение кислорода. Так, система фермент + диоксифумаровая кислота + цианид калия (КСМ) поглощает больше кислорода за 30 мин (508 мкл), чем система фермент + диоксифумаровая кислота (400 мкл). Оказывается, что продукты окисления диоксифумаровой кислоты — гликолевый альдегид и глиоксалевая кислота — вступают в реакцию с цианидом калия и образуют циангидриды, поэтому фермент и не ингибируется.
Диоксифумаровая кислота подвергается самоокислению при pH 6, Мп2+ катализирует окисление при действии супероксида с образованием Мn3+. Окисление диоксифумаровой кислоты также катализирует Сu2+ при pH 6.
Опыт, проведенный с супероксидом дисмутазой и каталазой, позволяет предположить, что здесь имеют место два типа окисления: энзиматическое, зависящее от присутствия перекиси водорода при пероксидазном окислении, и неэнзиматическое окисление, включая окисление диоксифумаровой кислоты под действием О2 .
Влияние супероксида О2- на окисление диоксифумаровой кислоты наводит на мысль, что эта кислота восстанавливает O2 до O2- который затем более легко реагирует с диоксифумаровой кислотой по следующей схеме: 
где [X]· является свободным радикалом, образованным при потере электрона диоксифумаровой кислотой [120].
Супероксид дисмутаза полностью восстанавливает согласно схеме 2O-+H2→H2O2, а каталаза разлагает перекись водорода до воды и кислорода, благодаря этим процессам живые клетки предохраняются от избыточного окисления.
Раствор диоксифумаровой кислоты при pH 6 содержит некоторые количества и Н2O2. Поэтому диоксифумаровая кислота в аэробных условиях легко подвергается самоокислению.
Источники:
http://studopedia.ru/12_112154_I-oksidoreduktazi.html
http://studwood.ru/1777278/matematika_himiya_fizika/fermenty_klassa_oksidoreduktaz_oksidazy_polifenoloksidazy
http://vinograd.info/knigi/osnovy-biohimii-vinodeliya/fermenty-4.html




