Окислительно-восстановительные процессы и вкусовые характеристики вин – Процессы окисления и восстановления в винах
Окислительно-восстановительные процессы и вкусовые характеристики вин – Процессы окисления и восстановления в винах
ОВ-процессы в сусле и вине
Окислительно-восстановительные процессы, протекающие в винах
Окислительно-восстановительные процессы, протекающие в винах, обусловлены поглощением кислорода воздуха при технологических операциях (переливка, фильтрация). Растворимость кислорода в вине зависит от температуры, спиртуозности, содержание экстрактивных веществ. При повышении температуры и экстрактивности растворимость кислорода понижается, а при увеличении концентрации спирта – увеличивается. Максимальная растворимость кислорода в вине может колебаться в пределах 8-10 мг/дм3. Часть кислорода связывается необратимо с компонентами вина в виде перекисных соединений. Содержание «перекисного кислорода» в вине может достигать 3 мг/дм3.
Окисление и восстановление взаимосвязаны между собой. По современным представлениям в этих процессах происходит потеря и приобретения электронов. Вещество окисляется, когда оно теряет электрон или приобретает положительный заряд.
При этом может быть 4 типа реакций:
1. Реакция присоединения кислорода

Где 
(потеря двух элементов)
2. Дегидрирование, то есть потеря водорода

3. Дегидрирование с предварительной гидратацией

4. Реакция, в которой не участвуют кислород или водород. Здесь происходит потеря электрона, в результате чего увеличивается валентность

Если реакция идёт в обратном направлении, то есть получением отрицательного заряда или электрона, отдачей кислорода, присоединением водорода или же уменьшением валентности, то этот процесс называется восстановлением:

Оба процесса являются сопряженными: одно вещество восстанавливается, другое – окисляется. Это основное превращение веществ имеет место в винограде, в сусле, в вине.
По мнению ряда ученых, эти процессы являются основными в формировании и вкуса, и букета выдержанных вин. Вместе с тем, существуют различные точки зрения на Роль кислорода при созревании. Ряд ученых считают необходимым ограничить поступление О2 в вино, напротив, другие специалисты предпочитают вводить О2 для улучшения созревания. Еще Бертло, встряхивая вино в присутствии О2, показал, что аромат становиться слабым, исчезает характерный вкус, качество вина снижается. С другой стороны, Пастер установил, что при выдержке вина в запаянных ампулах без О2 созревание вина останавливается и развитие типичного букета и вкуса не происходит. В настоящее время считают, что для созревания вина определенного типа необходимо строго определённое количество кислорода.
Из табл. видно, что в зависимости от типа вина ему потребуется за период созревания от 20 до 200 мг/дм3 кислорода
Таблица Потребность в кислороде различных типов вин ( по проф. В. И. Нилову)
Окислительно-восстановительные процессы
Окислительно-восстановительные процессы (ОВП) играют важную роль в жизнедеятельности организма, поскольку именно в процессах окисления происходит выделение и запас энергии, а восстановительные процессы связаны с биосинтезом белков, нуклеиновых кислот, полисахаридов в организме. Окислительно-восстановительные реакции – это реакции, идущие с переносом электронов и изменением степени окисления элементов.
ОВП состоят из двух одновременно протекающих и противоположно направленных процессов – окисления и восстановления. Окисление – это процесс отдачи электронов, в ходе которого происходит увеличение степени окисления элементов. Восстановление – это процесс присоединения электронов, в ходе которого происходит уменьшение степени окисления элементов. Окислитель – это вещество, атом которого принимает электроны, тем самым уменьшая степень окисления. Восстановитель – это вещество, атом которого отдает электроны, тем самым увеличивая степень окисления. ОВП подразделяются на три типа.
1. Межмолекулярные, в которых окислитель и восстановитель находятся в разных молекулах, например:
окислитель – Mn +7 , восстановитель – N +3 .
2. Внутримолекулярные, в которых окислитель и восстановитель находятся в одной молекуле, но являются разными элементами, например:
2KCl +5 O3 -2 = 2KCl -1 + 3O4 0
окислитель – Cl +5 , восстановитель – O -2 .
3. Диспропорционирования (самоокисления – самовосстановления), в которых окислителем является один и тот же элемент в одной и той же степени окисления, например:
3Cl2 0 + 6KOH = 5КСl -1 + KCl +5 O3 + 3H2O
окислитель – Cl 0 , восстановитель – Cl 0 .
В ходе окислительно-восстановительных процессов между частями системы происходит перераспределение зарядов. Возникающая разность зарядов между частями системы носит название потенциал. Существует несколько видов потенциалов, связанных с прохождением различных процессов.
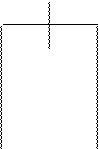
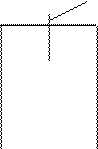
Одним из них является электродный потенциал, который возникает в том случае, когда пластинку металла погружают в раствор его соли (например, пластинку цинка в раствор сульфата цинка). При этом возможно прохождение двух процессов, которые определяются активностью металла и концентраций его катиона в растворе (рис.1).
 Ме Ме
Ме Ме
 + _ + _ _
+ _ + _ _

 Ме n+ + _ + Ме n+ _ + _
Ме n+ + _ + Ме n+ _ + _
 + _ + _ + _
+ _ + _ + _


рис. 1 Виды электродных процессов
Первый процесс происходит в том случае, когда активность металла высока, а концентрация его катиона невелика. В этом случае (см. рис. 1) ионы металла, находящиеся в узлах кристаллической решетки металла, вследствие гидратации будут переходить в раствор, заряжая его положительно; электроны, входящие в состав «электронного газа» (особенности металлической связи) остаются на куске металла, придавая ему отрицательный заряд.
В случае низкой активности металла и высокой концентрации его катиона процесс может идти в другом направлении (см. рис. 2). Катионы металла могут перейти на пластинку, достраивая кристаллическую решетку металла и придавая ей положительный заряд; анионы соли остаются в растворе, заряжая его отрицательно. В обоих процессах между пластинкой металла и раствором его соли возникает разность зарядов, называемая электродным потенциалом Е. Независимо от механизма возникновения электродного потенциала, он определяется окислительно-восстановительным процессом, а его величина – уравнением Нернста:


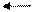
 Me Me n+ + ne –
Me Me n+ + ne –
 Zn Zn 2+ + 2e –
Zn Zn 2+ + 2e –
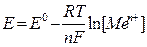
где: Е – потенциал системы,
Е 0 – стандартный потенциал системы, т.е. потенциал, определенный в стандартных условиях (Т=292 К, р=1 атм, [Red] = [Ох] = 1 моль/л)
Т – абсолютная температура,
n – число электронов, участвующих в процессе,
R = 8,31 Дж/моль * К,
F = 96500 Кл/моль
[Ме п+ ] – равновесная концентрация соли данного металла.
Подставляя постоянные при 25 0 С, получим:

По величине стандартного электродного потенциала все металлы выстраиваются в электрохимический ряд напряжений.
Одним из основных является окислительно-восстановительный потенциал. Его возникновение связано с обратимостью окислительно-восстановительных процессов. Одно и то же вещество в зависимости от условий может находиться либо в окисленной (Oх), либо восстановленной (Red) форме. Между этими двумя формами идут процессы взаимного перехода, сопровождающиеся изменением заряда системы. Процесс взаимного перехода идет до тех пор, пока между двумя формами не установится равновесие:

 Red Ox + ne
Red Ox + ne

 Fe 2+ Fe 3+ + e
Fe 2+ Fe 3+ + e
После установления равновесия в системе возникает избыточный заряд, называемый окислительно-восстановительным или редокс-потенциалом. Его величина определяется уравнением Нернста:
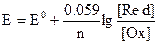
где: Е – потенциал системы,
Е 0 – стандартный потенциал системы, т.е. потенциал, определенный в стандартных условиях (Т=292 К, р=1 атм, [Red] = [Ох] = 1 моль/л)
[Red], [Ох] – равновесные концентрации восстановленной и окисленной форм.
Любой окислительно-восстановительный процесс можно представить как взаимодействие двух редокс-систем – системы окислителя и системы восстановителя. Направление ОВП будет определяться величинами редокспотенциалов систем.
При этом можно выделить следующие закономерности:
1. Одна и та же редокс-система может являться как окислителем, так и восстановителем – это зависит от соотношения величин потенциалов;
2. Системы с более отрицательным потенциалом будут восстанавливать системы с более положительным потенциалом;
3. После прохождения ОВП потенциалы редокс-систем выравниваются.
Возникновение разности зарядов между частями системы может быть и не связано с прохождением ОВП. Так, в ходе процесса диффузии между частями раствора, вследствие различной подвижности ионов, возникает разность зарядов, называемая диффузным потенциалом. Диффузный потенциал существует недолго и исчезает по окончании процесса диффузии.
Если два раствора разделить полупроницаемой мембраной, то на сторонах мембраны возникает разность зарядов, называемая мембранным потенциалом. Возникновение мембранного потенциала связано с тем, что вследствие различного размера ионов они могут проходить или не проходить через мембрану.
В живых организмах, вследствие наличия многочисленных мембран, направленного транспорта веществ и прохождения различных ОВП между его частями, возникает разность зарядов, называемая биопотенциалами. По своей природе биопотенциалы могут быть диффузными, мембранными и редокспотенциалами. Биопотенциалы играют важнейшую роль в направленном транспорте веществ, работе мембранных систем, процессах биосинтеза, выделение и запасание энергии. Выделение и запасание организмом энергии тесно связано с процессами окисления и восстановления.
77.243.189.108 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Процессы, происходящие при формировании вин
В вине, как и в любой сложной биохимической системе, непрерывно происходят сложные физико-химические и биохимические процессы, позволяющие вину поддерживать свои жизненные процессы. Жизнь вина проходит через пять этапов: образование молодого вина, его формирование, созревание, старение и отмирание.
Образование молодого вина — это период от момента дробления винограда до завершения процесса брожения. Для первой стадии этого этапа, включающей в себя дробление, прессование мезги и осветление, характерны процессы экстракции и диффузии, а также первичные и вторичные окислительно-восстановительные процессы, происходящие под действием ферментов, активизирующиеся после дробления ягод и попадания их в сусло.
Вторая стадия образования молодого вина включает в себя сам процесс брожения сусла или мезги, в результате чего принципиально изменяются исходные свойства продукта (сусла) и в значительной мере — его состав. Наибольшим количественным изменениям подвергаются сбраживаемые сахара, которые при производстве сухих натуральных вин полностью используются дрожжами. В процессе спиртового брожения, помимо главных продуктов — этилового спирта и углекислоты, образуются вторичные продукты, играющие большую роль в создании вкуса и аромата вин. К ним относятся глицерин, янтарная и уксусная кислоты, ацетальдегид, 2,3-бутиленгликоль, ацетоин, лимонная и пировиноградная кислоты, изоамиловый и изопропиловый спирты, эфиры. К концу брожения молодое вино обогащается полипептидами и аминокислотами — продуктами автолиза дрожжей. Фенольные соединения, реагируя с белками вина, образуют таннаты, выпадающие в осадок. Кислоты сусла, так же как и вновь образующиеся при брожении кислоты, частично окисляются или подвергаются превращениям по циклу ди- и трикарбоновых кислот. Витамины в первый период брожения потребляются дрожжами, а после автолиза происходит обратный переход их в вино. Окислительно-восстановительный потенциал (ОВ) по мере сбраживания сусла уменьшается (с 355—485 мВ до 135), достигая минимума в период бурного брожения, когда происходит полное потребление кислорода.
Формирование вина включает период от окончания брожения до момента первой переливки, т. е. до отделения молодого вина от осадка дрожжей.
Установлено, что на качество вина существенно влияют условия и сроки выдержки вина над осадком. При свободном доступе кислорода аминокислоты дрожжей могут стать источником образования нежелательных продуктов— альдегидов и аммиака, придающих винам неприятные тона окисления. Настаивание вина на осадочных винных дрожжах (1—2% массы вина) при 0—10°С устраняет указанный дефект, так как в этих условиях дрожжи выделяют в вино ферменты, но не обогащают его растворимыми азотистыми веществами.
Наиболее важным для этапа формирования является процесс так называемого “биологического понижения кислотности вин”, сущность которого заключается в превращении яблочной кислоты в молочную под действием молочнокислых бактерий Lactobacillus Leuconostoc или Pediococcus. Так как молочная кислота по сравнению с яблочной менее диссоциирована и имеет более мягкий вкус, рН вина повышается, исчезает его “зеленая”, резкая кислотность, вкус смягчается.
Этапы созревания и старения вина включают время выдержки его в бочках (резервуарах) и бутылках.
При созревании, протекающем от 2 до 4 лет при доступе кислорода воздуха, вино приобретает стабильность и присущие типу органолептические свойства, т. е. становится “розливозрелым”. Старение вина происходит без доступа воздуха в течение 4—12 лет и более. В этот период полностью развиваются тонкий вкус и специфический аромат, свойственные старым винам определенного типа.
Изменения в составе и качестве вин при созревании обусловлены сложными физико-химическими превращениями, из которых наибольшее значение имеют процессы окислительно-восстановительного характера и сахаро-амин-ные реакции. Поэтому очень важно обеспечить необходимый доступ кислорода в процессе выдержки вина. Взаимодействие составных частей вина с кислородом способствует уменьшению его терпкости в результате окисления полифенолов.
Переводя в осадок легкоокисляемые соединения, кислород повышает тем самым стабильность вин и способствует формированию их органолептических свойств. Избыток поглощенного кислорода приводит к переокислению вина в результате окислительного дезаминирования аминокислот с образованием из них аммиака и альдегидов, придающих вину горький привкус. При значительном накоплении этих продуктов “переокисленный” тон вина переходит в “мышиный”. Причины окисленного тона вина окончательно не установлены. Некоторые исследователи объясняют появление этого дефекта присутствием диацетила.
Старение вина начинается с момента, когда окислительные процессы не могут больше улучшать вкусовые и ароматические свойства вина. Вкус и аромат старого вина создаются при низком ОВ-потенциале. Наиболее тонкий букет в выдержанном вине бывает при величине ОВ-потенциала не выше 200—250 мВ.
Считается, что наибольшую роль в улучшении органолептических свойств вин при старении играют реакции этерификации, при которых из спирта и кислот образуются сложные эфиры. Однако прямой зависимости между качеством вина и содержанием в нем эфиров не установлено. Более того, отмечено, что при избыточном накоплении уксусноэтилового эфира в вине наблюдается неприятный привкус (“штих”). При взаимодействии альдегидов и спиртов образуются ацетали, являющиеся ценными компонентами букета вин. На формирование букета благоприятно влияют аминокислоты и продукты их взаимодействия с сахарами — меланоидины. Реакции меланоидинообразования наиболее интенсивно протекают в специальных винах. Продукты распада Сахаров придают вину карамельные (малажные) тона. При их чрезмерном развитии в таких винах, как херес, мадера и мускаты, теряется свойственный типу вина вкус и аромат.
В результате реакций этерификации и конденсации на внутренних стенках посуды, в которой выдерживается вино, появляются осадки (рубашка), состоящие из полимеризованных красящих веществ и других соединений. Этот процесс особенно характерен для красных вин.
Отмирание вина является конечной стадией его развития. Оно связано с необратимым распадом основных его компонентов и всей системы в целом. Объективными признаками начавшегося распада вин являются выпадение красящих веществ в осадок и приобретение вином неопределенного цвета с грязноватым оттенком, потеря аромата и появление неприятного запаха разложения, резкое изменение и ухудшение вкуса, обусловленное разрушением спирта и органических кислот и накоплением продуктов распада.
Срок жизни вина в основном зависит от его типа, качества и условий хранения, но рано или поздно вино разрушается. Лучшие натуральные вина можно выдерживать до 30—35 лет, а наиболее экстрактивные высококачественные специальные крепкие и десертные вина — до 100 лет и более.
Источники:
http://vinograd-vino.ru/protsessy-proiskhodyashchie-pri-izgotovlenii-vina/178-ov-protsessy-v-susle-i-vine.html
http://studopedia.ru/4_93117_okislitelno-vosstanovitelnie-protsessi.html
http://znaytovar.ru/new85.html




