Окислительно-восстановительные процессы и редокс-системы в вине – Процессы окисления и восстановления в винах
Окислительно-восстановительные процессы и редокс-системы в вине – Процессы окисления и восстановления в винах
Процессы окисления и восстановления в винах – Окислительно-восстановительные процессы и редокс-системы в вине
Содержание материала
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ И РЕДОКС-СИСТЕМЫ В ВИНЕ
Общие сведения об окислительно-восстановительных процессах
Вещество окисляется, когда оно связывает кислород или отдает водород; например, при сгорании серы S образуется сернистый ангидрид SO2, при окислении сернистой кислоты H2SO3 — серная кислота H5SO4, а при окислении сероводорода H2S — сера S; при окислении сульфата двухвалентного железа в присутствии кислоты образуется сульфат трехвалентного железа
4FeSO„ + 2H2SO4 + 02 = 2Fe2(SO4)3 + 2Н20.
или при распаде двухвалентного сульфата на анион SO
h катион Fe++ получают
4Fe++ + 6SO ” + 4Н+ + 02 = 4Fe+++ + + 6SO
+ 2H20,
или, сокращая анионы, не участвующие в реакции, находят
4Fe++ + 4Н+ + 02 = 4Fe+++ + 2Н20.
Последняя реакция идентична в случае окисления другой соли двухвалентного железа; она не зависит от природы аниона. Следовательно, окисление иона двухвалентного железа в ион трехвалентного железа заключается в увеличении его положительного заряда за счет иона водорода, который теряет свой заряд, образуя атом водорода, который соединяется с кислородом, чтобы дать воду. В результате при таком окислении происходит увеличение положительного заряда катиона, или, что то же самое, уменьшение отрицательного заряда аниона. Например, окисление сероводорода H2S заключается в превращении иона серы S в серу (S). В действительности в обоих случаях наблюдается потеря отрицательных электрических зарядов или электронов.
В противоположность этому при восстановлении хпроисходит уменьшение положительного заряда катиона или увеличение отрицательного заряда аниона. Например, о предыдущей реакции можно сказать, что наблюдается восстановление иона Н+ в атомный водород Н и что в обратном направлении реакции происходит восстановление иона Fe+++ в ион Fe++. Таким образом, восстановление сводится к увеличению количества электронов.
Однако, когда речь идет об окислении органических молекул, термин «окисление» сохраняет свой смысл превращения одной молекулы в другую или совокупность других, более богатых кислородом или менее богатых водородом. Восстановление же представляет собой обратный процесс, например окисление спирта СНз—СН2ОН в альдегид СН3—СНО, затем в уксусную кислоту СН3—СООН:
—2Н +Н,0-2Н
СН3—СН2ОН —> СН3—СНО–>
-> СН3—СООН.
Процессы окисления органических молекул в клетке, которые постоянно встречаются в биологической химии и в микробиологии, происходят чаще всего путем дегидрирования. Они сочетаются с процессами восстановления и составляют окислительно-восстановительные процессы, например окисление при спиртовом брожении между глицериновым и уксусным альдегидом, катализируемое кодегидразой и ведущее к спирту:
СН2ОН—СНОН—СНО + СН3—СНО + Н20 -+ СН2ОН—СНОН—СООН+СН3—СН2ОН.
Здесь речь идет о необратимом окислительно-восстановительном процессе, который, однако, может стать обратимым в присутствии катализатора, как будет показано ниже. Примером окисления-восстановления посредством обмена электронов и обратимого даже в отсутствие какого-либо катализатора является равновесие
Fe+++ + Cu+ Fe++ + Cu++.
Оно является суммой двух элементарных реакций, которые поставляет электрон
Fe++++e Fe++ и Cu+ Cu++ + е.
Такие элементарные обратимые реакции составляют окислительно-восстановительные системы или редокс-системы.
Они представляют непосредственный интерес для энологии. Действительно, с одной стороны, как было показано, ионы Fe++ и Cu+ автоокисляемы, т. е. они окисляются непосредственно, без катализатора, растворенным молекулярным кислородом, и окисленные формы могут повторно окислять другие вещества, следовательно, эти системы составляют катализаторы окисления. С другой стороны, они являются возбудителями помутнений, которые всегда опасны с точки зрения практики виноделия, и именно это обстоятельство тесно связано с их свойством переходить от одной валентности к другой.
Общий вид ионизированной окислительно-восстановительной системы, т. е. образуемой в растворе ионами, заряженными положительно или отрицательно, можно выразить так:
Red =5± Ох + е (или пе).
Общий вид органической окислительно-восстановительной системы, в которой переход компонента, восстановленного в окисленный, происходит путем освобождения водорода, а не электронов:
Red * Ох + Н2.
Здесь Red и Ох представляют молекулы, не имеющие электрических зарядов. Но в присутствии катализатора, например, одной из выше показанных окислительно-восстановительных систем или некоторых ферментов клетки Н,2 находится в равновесии со своими ионами и составляет окислительно-восстановительную систему первого типа
Н2 *± 2Н+ + 2е,
откуда при суммировании двух реакций получаем равновесие
Red * Ox + 2H+ + 2e.
Таким образом, приходим к виду, аналогичному виду ионизированных систем, выделяющих электроны одновременно с обменом водорода. Следовательно, эти системы, как и предыдущие, электроактивны.
Нельзя определить абсолютный потенциал системы; можно лишь измерить разность потенциалов между двумя окислительно-восстановительными системами:
Redi + Ох2 * Red2 + Oxj.
На этом принципе основаны определение и измерение окислительно-восстановительного потенциала такого раствора, как вино.
Классификация окислительно-восстановительных систем
Для того чтобы лучше рассмотреть окислительно-восстановительные системы вина и понять их роль, целесообразно воспользоваться классификацией Вурмсера, которая подразделяет их на три группы:
1) вещества непосредственно электроактивные, которые в растворе, даже одни, прямо обмениваются электронами с инертным электродом из платины, принимающим вполне определенный потенциал. Эти изолированные вещества составляют редокс-системы.
К ним относятся: а) ионы тяжелых металлов, составляющих системы Cu++/Cu+ и Fe++/Fe+++; б) многие красители, так называемые красители окисления-восстановления, используемые для колориметрического определения окислительно-восстановительного потенциала; в) рибофлавин, или витамин Вг, и дегидрогеназы, в которые он входит (желтый фермент), участвуя в клеточном дыхании в винограде или в дрожжах в аэробиозе. Это — автоокисляемые системы, т. е. в присутствии кислорода они принимают окисленную форму. Для их окисления кислородом не требуется катализатора;
2) вещества, обладающие слабой электроактивностью, которые не реагируют или реагируют слабо на платиновый электрод и самостоятельно не обеспечивают условий для равновесия, но становятся электроактивными, когда они находятся в растворе в присутствии веществ первой группы в очень слабых концентрациях и дают в этом случае определенный потенциал. Вещества второй группы реагируют с первыми, которые катализируют их окислительно-восстановительное превращение и делают необратимые системы обратимыми. Следовательно, красители окисления-восстановления позволяют исследовать вещества этой группы, определять для них нормальный потенциал и классифицировать их. Точно так же присутствие в вине ионов железа и меди делает электроактивными системы, которые, будучи изолированными, не являются окислительно-восстановительными системами.
К ним относятся: а) вещества с энольной функцией с двойной связью (—СОН = СОН—), в равновесии с ди-кетоновой функцией (—СО—СО—), например витамин С, или аскорбиновая, кислота, редуктоны, дигидрдксималеи-новая кислота; б) цитохромы, которые играют основную роль в клеточном дыхании как у растений, так и у животных;
3) электроактивные вещества в присутствии диастаз. Их дегидрирование катализируется дегидрогеназами, роль которых состоит в обеспечении переноса водорода из одной молекулы в другую. В целом этим системам придают электроактивность, которой они потенциально обладают, добавляя в среду катализаторы, обеспечивающие окислительно-восстановительные превращения; тогда они создают условия для окислительно-восстановительного равновесия и определенного потенциала.
Это системы молочная кислота — пировиноградная кислота в присутствии автолизата молочных бактерий, которые приводят в окислительно-восстановительное равновесие СН3— СНОН—СООН и СНз—СО—СООН — систему, участвующую в молочнокислом брожении; этанол — этаналь, которая соответствует переходу альдегида в спирт в процессе спиртового брожения, или же система бутандиол — ацетоин. Последние системы не имеют значения для самого вина, хотя и можно предположить, что вино может содержать дегидразы в отсутствие микробиальных клеток, но они имеют значение для спиртового или молочнокислого брожения, а также для готового вина, содержащего живые клетки. Они объясняют, например, восстановление этаналя в присутствии дрожжей или бактерий — факт, известный с давних пор.
Для всех этих окисляющих или восстанавливающих веществ можно определить окислительно-восстановительный потенциал, нормальный или возможный, для которого система наполовину окислена и наполовину восстановлена. Это позволяет классифицировать их в порядке окисляющей или восстанавливающей силы. Можно также заранее предвидеть, в какой форме (окисленной или восстановленной) находится данная система в растворе с известным окислительно-восстановительным потенциалом; предсказать изменения содержания растворенного кислорода; определить вещества, которые окисляются или восстанавливаются первыми. Этот вопрос достаточно освещен в разделе «Понятие об окислительно-восстановительном потенциале».
Окислительно-восстановительные процессы
Окислительно-восстановительные процессы (ОВП) играют важную роль в жизнедеятельности организма, поскольку именно в процессах окисления происходит выделение и запас энергии, а восстановительные процессы связаны с биосинтезом белков, нуклеиновых кислот, полисахаридов в организме. Окислительно-восстановительные реакции – это реакции, идущие с переносом электронов и изменением степени окисления элементов.
ОВП состоят из двух одновременно протекающих и противоположно направленных процессов – окисления и восстановления. Окисление – это процесс отдачи электронов, в ходе которого происходит увеличение степени окисления элементов. Восстановление – это процесс присоединения электронов, в ходе которого происходит уменьшение степени окисления элементов. Окислитель – это вещество, атом которого принимает электроны, тем самым уменьшая степень окисления. Восстановитель – это вещество, атом которого отдает электроны, тем самым увеличивая степень окисления. ОВП подразделяются на три типа.
1. Межмолекулярные, в которых окислитель и восстановитель находятся в разных молекулах, например:
окислитель – Mn +7 , восстановитель – N +3 .
2. Внутримолекулярные, в которых окислитель и восстановитель находятся в одной молекуле, но являются разными элементами, например:
2KCl +5 O3 -2 = 2KCl -1 + 3O4 0
окислитель – Cl +5 , восстановитель – O -2 .
3. Диспропорционирования (самоокисления – самовосстановления), в которых окислителем является один и тот же элемент в одной и той же степени окисления, например:
3Cl2 0 + 6KOH = 5КСl -1 + KCl +5 O3 + 3H2O
окислитель – Cl 0 , восстановитель – Cl 0 .
В ходе окислительно-восстановительных процессов между частями системы происходит перераспределение зарядов. Возникающая разность зарядов между частями системы носит название потенциал. Существует несколько видов потенциалов, связанных с прохождением различных процессов.
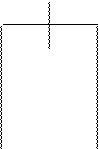
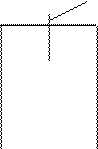
Одним из них является электродный потенциал, который возникает в том случае, когда пластинку металла погружают в раствор его соли (например, пластинку цинка в раствор сульфата цинка). При этом возможно прохождение двух процессов, которые определяются активностью металла и концентраций его катиона в растворе (рис.1).
 Ме Ме
Ме Ме
 + _ + _ _
+ _ + _ _

 Ме n+ + _ + Ме n+ _ + _
Ме n+ + _ + Ме n+ _ + _
 + _ + _ + _
+ _ + _ + _


рис. 1 Виды электродных процессов
Первый процесс происходит в том случае, когда активность металла высока, а концентрация его катиона невелика. В этом случае (см. рис. 1) ионы металла, находящиеся в узлах кристаллической решетки металла, вследствие гидратации будут переходить в раствор, заряжая его положительно; электроны, входящие в состав «электронного газа» (особенности металлической связи) остаются на куске металла, придавая ему отрицательный заряд.
В случае низкой активности металла и высокой концентрации его катиона процесс может идти в другом направлении (см. рис. 2). Катионы металла могут перейти на пластинку, достраивая кристаллическую решетку металла и придавая ей положительный заряд; анионы соли остаются в растворе, заряжая его отрицательно. В обоих процессах между пластинкой металла и раствором его соли возникает разность зарядов, называемая электродным потенциалом Е. Независимо от механизма возникновения электродного потенциала, он определяется окислительно-восстановительным процессом, а его величина – уравнением Нернста:


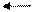
 Me Me n+ + ne –
Me Me n+ + ne –
 Zn Zn 2+ + 2e –
Zn Zn 2+ + 2e –
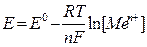
где: Е – потенциал системы,
Е 0 – стандартный потенциал системы, т.е. потенциал, определенный в стандартных условиях (Т=292 К, р=1 атм, [Red] = [Ох] = 1 моль/л)
Т – абсолютная температура,
n – число электронов, участвующих в процессе,
R = 8,31 Дж/моль * К,
F = 96500 Кл/моль
[Ме п+ ] – равновесная концентрация соли данного металла.
Подставляя постоянные при 25 0 С, получим:

По величине стандартного электродного потенциала все металлы выстраиваются в электрохимический ряд напряжений.
Одним из основных является окислительно-восстановительный потенциал. Его возникновение связано с обратимостью окислительно-восстановительных процессов. Одно и то же вещество в зависимости от условий может находиться либо в окисленной (Oх), либо восстановленной (Red) форме. Между этими двумя формами идут процессы взаимного перехода, сопровождающиеся изменением заряда системы. Процесс взаимного перехода идет до тех пор, пока между двумя формами не установится равновесие:

 Red Ox + ne
Red Ox + ne

 Fe 2+ Fe 3+ + e
Fe 2+ Fe 3+ + e
После установления равновесия в системе возникает избыточный заряд, называемый окислительно-восстановительным или редокс-потенциалом. Его величина определяется уравнением Нернста:
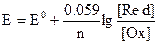
где: Е – потенциал системы,
Е 0 – стандартный потенциал системы, т.е. потенциал, определенный в стандартных условиях (Т=292 К, р=1 атм, [Red] = [Ох] = 1 моль/л)
[Red], [Ох] – равновесные концентрации восстановленной и окисленной форм.
Любой окислительно-восстановительный процесс можно представить как взаимодействие двух редокс-систем – системы окислителя и системы восстановителя. Направление ОВП будет определяться величинами редокспотенциалов систем.
При этом можно выделить следующие закономерности:
1. Одна и та же редокс-система может являться как окислителем, так и восстановителем – это зависит от соотношения величин потенциалов;
2. Системы с более отрицательным потенциалом будут восстанавливать системы с более положительным потенциалом;
3. После прохождения ОВП потенциалы редокс-систем выравниваются.
Возникновение разности зарядов между частями системы может быть и не связано с прохождением ОВП. Так, в ходе процесса диффузии между частями раствора, вследствие различной подвижности ионов, возникает разность зарядов, называемая диффузным потенциалом. Диффузный потенциал существует недолго и исчезает по окончании процесса диффузии.
Если два раствора разделить полупроницаемой мембраной, то на сторонах мембраны возникает разность зарядов, называемая мембранным потенциалом. Возникновение мембранного потенциала связано с тем, что вследствие различного размера ионов они могут проходить или не проходить через мембрану.
В живых организмах, вследствие наличия многочисленных мембран, направленного транспорта веществ и прохождения различных ОВП между его частями, возникает разность зарядов, называемая биопотенциалами. По своей природе биопотенциалы могут быть диффузными, мембранными и редокспотенциалами. Биопотенциалы играют важнейшую роль в направленном транспорте веществ, работе мембранных систем, процессах биосинтеза, выделение и запасание энергии. Выделение и запасание организмом энергии тесно связано с процессами окисления и восстановления.
77.243.189.108 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Окислительно-восстановительные процессы сусла и вина
ОВ системы сусла и вина
Об окислительно-восстановителных (ОВ) системах сусла и вина известно немного. Профессор З. Н. Кишковский и профессор И. М. Скурихин, используя введенное Кларком новое понятие RH2, впервые в 1988 г рассчитали и представили рядом все известные окислительно-восстановительные системы виноградного сусла и вина.
Молочная – пировиноградная кислота
Цистеи RН2 =
RН2 =  ,
,
Где Eh – окислительно-восстановительный потенциал, В.
Чем меньше rН2, тем выше восстановительная способность раствора.
Окислительно-восстановительные процессы (ОВ-процессы) Играют важную роль в виноделии и проявляются уже на первых этапах переработки винограда. Они имеют как положительное, так и отрицательное значение в зависимости от доз кислорода, глубины и направленности происходящих реакций.
Умеренное поступление в сусло кислорода воздуха (10— 20 мг/л, не более) является нормальным для здорового винограда и обеспечивает получение чистых здоровых вин высокого качества. При этом за счет окислительной конденсации выпадают легкоокисляемые фенольные вещества, что гарантирует стабильность получаемых вин к дальнейшему окислению.
Избыточное (30—40 мг/л и более) поступление кислорода приводит к получению окисленных вин с обедненным сортовым ароматом, простым, «выветренным» вкусом. Особенно опасна с точки зрения окисления переработка винограда, пораженного серой гнилью. Окислительные процессы в мезге и сусле такого винограда проходят во много раз быстрее и интенсивнее. Вино из плесневелого винограда может приобретать вкус уваренности, а его цвет независимо от цвета ягод — буро-коричневую окраску. Это называется оксидазным поражением винограда и приводит к необратимому переокислению вина — оксидазному кассу.
ОВ-процессы вызываются содержащимися в ягодах винограда окислительными ферментами: полифенолоксидазой, пероксидазой, аскорбинатоксидазой и др.
Наиболее мощная окислительная система — полифенолоксидазная, действующая на монофенолы, о-дифенолы и полифенолы по окислительно-восстановительному принципу «полифенол — хинон», — была открыта акад. В. И. Палладиным.
Фенольные вещества под действием окислительных ферментов окисляются в хиноны:

Этот процесс обратим, если в сусле есть восстанавливающие вещества — редуктоны, например аскорбиновая кислота:
0-Хинон + аскорбиновая кислота → о-дифенол + дегидроаскорбиновая кислота.
Когда все редуктоны дегидрируют, появляющиеся хиноны в присутствии воды образуют оксихиноны, которые, конденсируясь, дают темноокрашенные нерастворимые продукты. Эти продукты являются конечными, необратимыми в окислительных реакциях; они выпадают в осадок.
Вовлечение в окислительно-восстановительные процессы редуктонов сусла, расходуемых на восстановление хинонов, приводит к снижению его витаминной ценности.
Основной вред переокисление фенольных веществ наносит аромату и цвету будущего вина. Так, при активном окислении терпеновые спирты (линалоол, гераниол, цитронеол и др.), составляющие основу эфирного масла ягод, окисляются до фурановых и пирановых оксидов. Вино из окисленного сусла не имеет фруктового аромата. Переокисление приводит к необратимому окислению антоцианов, некоторых аминокислот. В них накапливаются продукты окисления – альдегиды, хиноны, флобафены, меланоидины и другие соединения. Они допустимы только для специальных вин типа Мадеры, токая, хереса, технология которых предусматривает проведение интенсивных окислительных процессов для придания типичности. Во всех остальных случаях окисление сусла и вина недопустимы.
Исходя из того, что носителями окислительных ферментов являются твердые части винограда – мякоть и кожица, стремятся не допустить их в бродящее сусло, удалить отстаиванием или центрифугированием. Для снижения интенсивности окислительно-восстановительных процессов сусло сульфитируют рассчитанными дозами SO2.
Во избежание окисления отдают предпочтения быстрым методам переработки винограда, прессованию целых гроздей, созданию анаэробных условий виноделия.
Переработка винограда машинами связана с разрушением твердых частей мякоти, при этом сусло обогащается ферментами, фенольными соединениями, нарушается последовательность окислительно-восстановительных процессов. Поэтому в последние годы модернизирован весь парк машин первичной переработки винограда.
Например, созданы и повсеместно используются гребнеотделители-дробилки, в которых сперва от гроздей отрывают ягоды, а затем их подвергают щадящему раздавливанию на валках. Мезгу теперь перемешивают насосами шнекового типа, а вместо непрерывнодействующих прессов, перетирающих мезгу вместе с семенами, повсеместно применяют мягко работающие мембранные прессы.
Современное виноделие подчиняется идеям, открытым благодаря исследованию биохимических процессов при переработке винограда. На винзаводах Украины и Молдовы очень хорошо зарекомендовали себя так называемые «щёковые прессы», в которых поступивший виноград сразу же отжимается в приемных бункерах. Во Франции на специальных аппаратах Фабри сбраживают целые нераздавленные грозди винограда в атмосфере углекислого газа. Изобретатель этой технологии господин Фланзи назвал его методом углекислотной мацерации.
Регулирование окислительно-восстановительных процессов стало необходимой основой в управлении технологическими этапами приготовления, формирования и созревания вина.
Источники:
http://vinograd.info/knigi/teoriya-i-praktika-vinodeliya/processy-okisleniya-i-vosstanovleniya-v-vinah-4.html
http://studopedia.ru/4_93117_okislitelno-vosstanovitelnie-protsessi.html
http://vinograd-vino.ru/protsessy-proiskhodyashchie-pri-izgotovlenii-vina/246-okislitelno-vosstanovitelnye-protsessy.html





