Метод гравийной культуры при изучении вопросов питания виноградного растения
Метод гравийной культуры при изучении вопросов питания виноградного растения
МИНЕРАЛЬНОЕ ПИТАНИЕ
Физиологическая роль элементов минерального питания
Вегетационный метод и его роль в изучении минерального питания растений
Изучение питания растений можно разделить на три основных этана. Первый этап — эмпирический. В древние времена в науке господствовало представление о том, что растения строят свое тело из «соков земли», отчетливо сформулированное уже Аристотелем (Древняя Греция, 384—322 гг. до н.э.), который учил, что растение, в отличие от животного, не имеет желудка и других органов пищеварения, эти органы ему заменяет почва, где происходит переваривание пищи. Следовательно, растение берет пищу из почвы в готовом виде. Эти представления возникли из многовекового опыта земледельцев, которые издавна научились отличать плодородные почвы от бесплодных и хорошо знали, какое значение имеет обработка почвы и ее удобрение навозом, гипсом, золой для получения урожая. В течение многих веков эти взгляды не вызывали сомнений.
Начало второго, экспериментального, этапа связано с именем голландца Ван Гельмонта, который в 1600 г. попытался решить вопрос о питании растений с помощью очень простого опыта. Посадив ветвь ивы, имеющую массу 2,25 кг, в сосуд с 80 кг сухой почвы и регулярно поливая ее, он через пять лет обнаружил, что масса почвы уменьшилась лишь на 56 г, в то время как ветка превратилась в деревце массой в 66 кг. На основании этого опыта Ван Гельмонт сделал вывод, что растение само готовит себе пищу, строит свое тело только из воды, а минеральные вещества, обнаруживаемые после его сжигания, не имеют никакого значения. Это мнение просуществовало в науке 200 лет.
В 1804 г. швейцарец Н. Т. Соссюр, напротив, показал, что растения, выращиваемые только на воде, не могут нормально расти, поскольку в природных условиях они получают все необходимые элементы из почвы. Однако решающий удар по этим наивным представлениям нанесло изучение фотосинтеза. Точными опытами было доказано, что 95% своего тела растения строят за счет С02 воздуха и воды. Оставалось узнать, откуда берутся остальные составные части растения и являются ли они столь же необходимыми, как углекислый газ и вода, или же они являются случайной примесью, попадающей в растение из почвы вместе с водой.
Для ответа на эти вопросы, прежде всего, нужно было установить состав веществ, поглощаемых растением из почвы. С этой целью растение высушивали и сжигали. При этом образовывались С02, вода, молекулярный азот или N113, Н23 и нелетучий остаток — зола. В результате анализов было установлено, что растения состоят на 50—98% из воды, а 45% сухого вещества приходится на долю углерода. Количество золы в разных органах растения неодинаково. Меньше всего ее содержится в древесине (около 1%), состоящей почти из одних мертвых клеточных стенок; в семенах золы — около 30%, в корнях и стеблях травянистых растений — 4—5, в листьях — 10—15%. Относительно много золы (около 7%) содержится в древесной коре. Таким образом, больше всего золы в тканях, состоящих преимущественно из живых клеток. В одинаковых органах растений различных видов количество золы тоже отличается. Так, в листьях картофеля можно найти от 5 до 13% золы, свеклы — 11—21, сахарного тростника — 5—16%.
Общее количество золы в сухом веществе растения и соотношения между отдельными элементами сильно зависят как от состава почвы, на которой росли растения, так и от других условий. Чем богаче почва солями и чем суше климат, тем больше золы накапливается в растении, хотя прямой пропорциональности между этими показателями не обнаружено.
Химический состав золы разнообразен. Из табл. 6.1 видно, что семена богаче фосфором и калием, стебли и листья — кремнием и кальцием, клубни и корни — калием. В таблице приведены только элементы, встречающиеся в растениях в наибольших количествах. Детальные исследования более позднего периода показали, что в золе можно найти почти все элементы периодической системы Д. И. Менделеева. Кроме того, многие элементы, находящиеся в земной коре в чрезвычайно малых дозах, накапливаются в растениях в больших количествах.
Состав золы различных сельскохозяйственных растений,
% от общего количества золы 1
Стебли и листья
1 Цит. с изм. по: Максимов II. Л. Краткий курс физиологии растений. М. : Гос. изд-во сельхоз. литературы, 1958.
Клубни и корнеплоды
Возник вполне естественный вопрос: «Какие из поглощаемых элементов нужны растению?» В процессе решения этого вопроса был доработан вегетационный метод, впервые примененный французским ученым Ж. Б. Буссенго в 1837 г. Вегетационный метод — выращивание растений в стеклянных домиках, оранжереях, теплицах, климатических камерах, фитотронах, в которых создаются определенные условия. Растения выращивают в искусственных условиях в особых вегетационных стеклянных или металлических сосудах, заполненных водой (водная культура), песком <песчаная культура)или почвой (почвенная культура). В зависимости от целей опыта в сосуды вносятся определенные удобрения или питательная смесь. Вегетационный метод стал основным в изучении питания растений.
Большое значение для выяснения роли разных элементов в жизни растения имел метод водной культуры, разработанный немецкими физиологами К). Саксом и И. Кнопом в 1860—1865 гг. Их работы положили начало третьему этапу изучения корневого питания растений. В русской науке большую роль в разработке вегетационного метода сыграли работы К. А. Тимирязева. Придавая большое значение этому методу выращивания растений, ученый много сделал для его популяризации в нашей стране. Он добился сооружения в 1896 г. первого в России вегетационного домика и лично демонстрировал возможности вегетационного метода в Нижнем Новгороде.
И. Кноп, выращивая растения на водных растворах, содержащих различные зольные элементы в разных соотношениях, установил, что растения могут нормально расти и развиваться только при наличии в питательном растворе семи элементов: К, Са, Э, Р, Ы, Бс. Среди этих элементов азот нс является зольным, так как при сжигании растения он улетучивается. С другими зольными элементами его объединяет то, что растение поглощает его из почвы, а нс из воздуха. Группируя эти элементы попарно в виде кислотных и основных окислов, И. Кноп составил очень простой раствор, который затем был назван его именем и получил широкое распространение. Питательный раствор Кнопа содержит в 1 л Са(М03)2 — 1 г; КТЬРО^ – 0,25 г; – 0,25 г; КС1 – 0,125 г и РеС13 – 0,0125 г.
Этот раствор используют и в настоящее время благодаря следующим его свойствам:
1) он универсален, т.е. пригоден для выращивания растений любых видов;
- 2) содержит все необходимые элементы в доступной форме;
- 3) это разбавленный раствор, имеющий низкий осмотический потенциал, поэтому вода легко поступает в корневые системы;
- 4) одно- и двухвалентные ионы уравновешены (см. подпараграф 6.2.3);
- 5) pH раствора около 7.
В течение многих лет на этом и похожих на него питательных растворах удавалось выращивать прекрасные растения, поэтому все остальные элементы, даже входящие в состав золы, были признаны ненужными.
Однако постепенно стали накапливаться факты, показывавшие, что многие из этих лишних элементов играют весьма важную роль в жизни растения. Решению этого вопроса помогло дальнейшее усовершенствование методов очистки химических реактивов от примесей и получение химически чистых веществ. При выращивании растений на питательном растворе Кнопа, приготовленном из таких химически чистых солей, оказалось, что начавшие развиваться проростки скоро гибнут.
В начале XX в., используя бидистиллированную воду, химически чистые соли и сосуды из кварцевого стекла, ученые доказали необходимость для растений также марганца, меди, бора, цинка, молибдена, хлора, натрия и др. В отличие от элементов раствора Кнопа, которые не оказывают вредного действия на растения при общей концентрации питательного раствора 200—300 мг/л, эти элементы при концентрации выше 0,1—0,5 мг/л угнетают рост растений.
Азот, сера, фосфор, кальций, магний и калий назвали макроэлементами. Марганец, медь, бор, цинк, молибден, хлор, натрий и некоторые другие элементы, угнетающие рост растения при концентрации выше 0,1 — 0,5 мг/л, получили название микроэлементов. Данное деление на микро- и макроэлементы условно, поскольку оно определяется количеством вещества, вносимого в виде удобрения в почву или в питательный раствор.
В настоящее время существует и другой принцип деления элементов на макро- и микроэлементы, основанный на их концентрации в растении по отношению к молибдену (табл. 6.2).
Содержание минеральных элементов в тканях растений 1
Концентрация, мкмоль/г сухого вещества
Относительное число атомов по сравнению с молибденом
1 LUit. c H3M.: Epstein E. The anatomy of silicon in plant biology // Proc. Natl. Acad. Sci. USA. 1994. V. 91. P. 11-17.
Концентрация, мкмоль/г сухого вещества
Относительное число атомов по сравнению с молибденом
М и кроэл ементы
Все элементы, входящие в состав питательного раствора, являются одинаково необходимыми для растений, отсутствие хотя бы одного из них приводит к остановке развития и к гибели растения. В 1937 г. Д. Арнон и П. Стоут, ввели критерий необходимости элемента: необходимый элемент должен быть включен в метаболизм, и при его отсутствии в среде растение не может пройти весь цикл развития. На рис. 6.1 видна огромная разница в развитии растений, выращиваемых на полной питательной смеси и на смеси, лишенной одного из элементов. Эта разница в развитии зависит также от содержания этого элемента в семени и потребности в нем растения.

Рис. 6.1. Выращивание растений на полной питательной смеси и с исключением отдельных элементов (водная культура):
- 1 — дистиллированная вода; 2 — все соли, кроме калия; 3 — кроме кальция; 4 — кроме азота; 5 — кроме фосфора; 6 — кроме магния; 7 — кроме железа;
- 8 — полная питательная смесь
Выращивая растения на полном питательном растворе и с исключением отдельных элементов, И. Кноп доказал, что зеленое растение на свету само может синтезировать все необходимые органические вещества из минеральных, т.е. является абсолютным автотрофом. Растения хорошо усваивают необходимые элементы из минеральных солей.
Почему же внесение в почву навоза и других органических веществ вызывает увеличение урожая? Во-первых, органические соединения улучшают структуру почвы, что влияет па ее водный и воздушный режим. Во-вторых, ими питаются почвенные бактерии и грибы, способствующие их минерализации. Минерализация — это разложение органических веществ с образованием минеральных неорганических соединений. В результате минерализации органических веществ С02 и элементы возвращаются в атмосферу, почву и воду.
Роль микроорганизмов в питании растений была выяснена в опытах, проведенных в стерильных условиях. Выращивание проростков или взрослых растений на питательной среде без микроорганизмов получило название стерильной культуры. Впервые метод стерильных культур был разработан в 1931 г. в СССР в лаборатории Д. Н. Прянишникова. Было показано, что корневые системы растений в стерильных условиях прекрасно поглощают растворимые минеральные соли, входящие в состав питательной смеси, и некоторые органические соединения, например аминокислоты. Более сложные нерастворимые органические вещества в отсутствии микроорганизмов не поглощаются растениями.
Широкое использование в физиологических исследованиях вегетационного метода привело к его модификации и развитию. Так, был разработан метод выращивания растений без почвы на искусственных питательных растворах, получивший название гидропоники. Наиболее распространены водно-гравийные культуры: растения выращивают в огромных сосудах с гравием, по которым течет с определенной скоростью питательный раствор. Вместо гравия можно употреблять другие материалы (гранулированный полиэтилен, вермикулит), не вступающие в химические реакции с веществами питательного раствора.
Метод выращивания растений без почвы, при котором корпи находятся во влажном воздухе и периодически опрыскиваются мелкими каплями питательного раствора, получил название аэропоники (воздушной культуры). Использование этих методов дало возможность создавать лучшие условия не только для питания растений, но и для дыхания корней.
В настоящее время при выращивании растений для научных целей используются фитотроны — специальные помещения, в которых регулируются температура и влажность воздуха, свет и другие факторы внешней среды. В последние годы на смену сложным стационарным фитотронам все чаще приходят компактные экономически эффективные климатические камеры. Использование фитотронов для сельскохозяйственных технологий нерентабельно из-за больших энергетических затрат и высокой себестоимости продукции.
Помимо выращивания на питательных растворах целых растений, ученые в середине XX в. разработали методы выращивания на питательной среде в стерильных условиях изолированных клеток, тканей или отдельных органов растений. Эти методы получили название культуры изолированных тканей, или органов (культуры in vitro). Благодаря этим методам изучение минерального питания растений значительно упростилось.
В XX в. началось изучение механизмов поглощения. Теория переносчиков Э. Эпштейна и других (Е. Epstein, 1966) и теория П. Митчелла (1961) позволили обосновать новые механизмы поглощения и транспорта веществ. В настоящее время наука о минеральном питании растений имеет следующие главные направления: поглощение ионов из среды и их ассимиляция, функции элементов, регуляция минерального питания и взаимодействие органов в распределении элементов питания.
Особенности методики полевого опыта с плодово-ягодными культурами
Опыты с плодово-ягодными культурами отличаются от опытов с однолетними культурами в силу биологических особенностей этих культур. Особенность эта заключается в многолетнем периоде жизни, продолжительности периода от посадки до наступления периода плодоношения, в периодичности плодоношения, в различном отношении ряда пород и сортов к почвенно-климатическим условиям.
Ошибка в опыте может быть вызвана неодинаковым состоянием плодовых растений из-за их индивидуальной изменчивости, а также за счет пестроты почвенного плодородия участка, площадь которого значительно больше, чем под другими культурами.
Опыты с плодово-ягодными культурами можно проводить как на ранее посаженных растениях, так и на вновь закладываемых насаждениях. Если исследования планируется проводить на существующих насаждениях, их тщательно изучают на протяжении 3-4 лет до закладки опыта. Насаждения должны быть однородными по сортовому и возрастному составу, должны возделываться до закладки опыта при одинаковой агротехнике. В этот период, до распределения деревьев и кустарников по вариантам, дают оценку каждому растению по габитусу и урожайности. Без учета этих показателей нельзя дать объективную оценку эффективности результатов опыта.
Опыты в плодоводстве обычно закладывают в 4-6-кратной повторности. Размер учетного участка для разных видов и сортов плодовых и ягодных культур зависит от цели опыта, площади питания, габитуса растения, отношения к свету и другим факторам жизни. В агротехнических опытах на каждой делянке в 1-2 ряда располагают следующее количество учетных растений: плодовых – 6-10 деревьев, кустарниковых ягодников – 10-20 растений, в питомнике – 40-60 растений. На концах рядов выделяют защитные растения: у плодовых культур – по 1-2 дерева, у кустарниковых ягодников – по 2 куста. С двух сторон вдоль делянок располагают 1-2 защитных ряда.
В опытах с плодовыми и ягодными культурами увеличение количества повторностей при уменьшении площади делянок приводит к росту точности результатов опытов. Поэтому наилучшие результаты можно получить, если взять каждое отдельное дерево за делянку – дерево-делянка или куст-делянка. При этом каждое растение одного варианта должно максимально быть отделено от подобного.
В опытах на вновь закладываемых насаждениях подбирают соответствующий участок. С целью окультуривания почвы и придания ей однородности проводят специальные мероприятия – плантажную вспашку и внесение органических и минеральных удобрений и извести с учетом особенностей опытных культур и зональных условий.
Посадочный материал перед выкапыванием из питомника измеряют, определяют диаметр штамба, высоту растения, прирост побегов и их количество. Из отобранных однородных саженцев методом случайной выборки выделяют опытные растения для каждого варианта.
В опытах с плодово-ягодными культурами проводят не только стандартные наблюдения, но и учет хозяйственно ценных признаков и биологических особенностей растений. Все признаки могут быть оценены объективными (биометрическими) методами с помощью приборов и субъективными методами с помощью органов чувств.
Растения под влиянием условий внешней среды в зависимости от этапов онтогенеза постоянно изменяются. Поэтому очень важно, откуда будут взяты для анализа те или иные органы растения. Для получения сравнимых данных при работе следует придерживаться определенных правил.
Правила отбора типичных образцов. При описании растений отбирают формы одновозрастные, одновременно посаженные, привитые на одноименном подвое, здоровые, произрастающие в условиях единого агрофона. Исследуемые растения должны иметь средний прирост в соответствии с биологическими особенностями культуры и неповрежденные листья.
Деревья и кустарники описываются после окончания роста побегов; листья плодовых и ягодных растений описывают в середине или во второй половине лета, плоды и ягоды – в период съемной или потребительской спелости.
Органы плодово-ягодных культур для описания следует отбирать с периферийных частей кроны, находящихся в условиях хорошего освещения, и из верхних ярусов кроны. У плодово-ягодных культур наиболее крупные цветы и плоды развиваются из центральных бутонов соцветия, они обладают более полно выраженными сортовыми признаками. Листья и почки плодово-ягодных культур отбирают из средней части побега. Побеги для описания отбирают на молодых плодовых деревьях длиной не менее 30-40 см, а у саженцев этих культур – 50-60 см. Проба для анализа составляет 25-30 штук листьев, цветов или плодов с одного дерева.
Определение и оценка общих признаков. При проведении опытов с плодово-ягодными культурами определяют следующие признаки: среднюю массу плода или ягоды, пораженность цветов и листьев болезнями и вредителями, среднюю величину листьев, степень цветения, степень подмерзания цветковых почек. При описании плодов и ягод учитывают следующие признаки:
1. Привлекательность внешнего вида плодов и ягод. Оценивают по сочетанию величины, формы, характеру поверхности, окраске и другим признакам. Оценка пятибалльная:
“5” – плоды или ягоды очень красивые, нарядные, без повреждений болезнями, вредителями, пятнами загара; размер – от средних до крупных; все плоды и ягоды пробы одномерные по величине, форма правильная; поверхность плодов гладкая, без сильной ребристости и бугристости, с красивой покровной окраской в виде размытого или полосато-размытого яркого румянца по всей или большей части поверхности плода; если плоды без покровной окраски, то основная окраска однотонная, тепловатых оттенков;
“4” – красивые плоды и ягоды удовлетворительного вида, имеют повреждения болезнями и вредителями, менее одномерные по величине, не всегда правильной формы; поверхность гладкая или слаборебристая, с покровной окраской размытого или размыто-полосатого характера или только с основной окраской зеленоватого цвета;
“3” – плоды и ягоды удовлетворительного вида, имеют повреждения болезнями и вредителями; размер – от мелких до средних, не очень привлекательной формы; поверхность плода ребристая или бугристая, без покровной окраски, основная окраска с зеленоватым оттенком;
“2” – плоды и ягоды мелкие, некрасивые, не одномерные, неприглядные по форме, поверхности и окраске, имеют поражения болезнями и вредителями,
“1” – очень некрасивые мелкие плоды и ягоды, как правило, без покровной окраски, поражены болезнями или вредителями.
2. Оценка вкуса плодов и ягод. Характер вкуса плодов и ягод определяют субъективно (очень кислый, кисловатый, сладковатый, сладкий, очень сладкий). При сочетании во вкусе кислоты и сахара дают определение вкуса сложными словами, причем на последнем месте в слове указывают то, что ощущают во вкусе в конце анализа (кисло-сладкий, сладко-кислый). Если сахар и кислота во вкусе ощущаются слабо, в меньшей концентрации, то вкус определяется как сладковатый, кисловатый или сладковато-кисловатый.
Вкус оценивается в баллах: “5” – отличный, десертный вкус, гармоничный, приятный; “4” – хороший столовый вкус, менее насыщенный; “3” – удовлетворительный (средний) вкус, не представляет особого интереса; “2” – плохой вкус, плоды или ягоды почти не пригодны для потребления в свежем виде; “1” – очень плохой вкус, плоды или ягоды совсем несъедобные.
3.Оценка аромата плодов и ягод. Вкусовые ощущения сопровождаются восприятием запаха или аромата, При оценке под запахом понимают недостаточно приятные ощущения, а под ароматом – только приятные. Совокупность запаха и аромата называют букетом, У плодов и ягод запах и аромат определяют следующими словами: нет аромата, слабый аромат, средний аромат, сильный аромат, очень сильный аромат. Иногда определяют ассоциативность данного аромата, К примеру, яблоки сорта Коричное полосатое имеют аромат. Напоминающий запах корицы.
4. Окраска плодов. Определяют с помощью набора таблиц немецкого физика Освальда или по шкале цветов Бондарцева. Иногда можно определять на основе цветов солнечного спектра. Сначала определяют основной цвет, затем его интенсивность, затем степень яркости. Если окраска имеет оттенок другого цвета, то устанавливают и его.
5. Общая оценка качества плодов и ягод. Дают на основании учета всех признаков. Выражают в баллах: “5” – плоды или ягоды отличного качества; “4” – хорошего качества; “3” – удовлетворительного качества; “2” – плохого качества; “1” – очень плохого качества.
Вегетационные опыты с песчаной и водной культурой
В опытах с песчаной культурой субстратом является песок, с водной – дистиллированная, бидистиллированная, иногда водопроводная вода. Песок и вода в отличие от почвы – бесплодные среды и их применяют, чтобы создать при изучении питания растений строго контролируемые условия.
С помощью песчаной культуры определяют, какие элементы необходимы растениям, какова роль каждого элемента, устанавливают их оптимальное соотношение, формы и дозы внесения, изучаются явления антагонизма и синергизма различных элементов и др. В опытах используют кварцевый или белый речной песок с частицами от 0,2 до 0,5 мм, отмытый от илистых частиц. Когда в опыте нужна особо чистая среда, песок 3–5 дней выдерживают в концентрированной соляной кислоте, после чего промывают сначала водопроводной, а затем дистиллированной водой до отрицательной реакции на хлор (с AgNO3).
Для зерновых, трав, бобовых используют сосуды, вмещающие 4–8 кг песка, для корнеплодов и клубнеплодов – 10–20 кг. Техника закладки и проведения опытов с песчаной культурой такая же, как и с почвенной, с той только разницей, что в песчаную культуру питательные элементы вводят с питательной смесью.
Питательная смесь содержит все необходимые элементы питания в усвояемой форме (соли) и в количествах, достаточных для нормального роста и развития растений. Питательная смесь должна обеспечивать физиологическую уравновешенность раствора и оптимальную, желательно нейтральную, реакцию на протяжении вегетационного периода. Существует множество разнообразных по составу питательных смесей, отличающихся набором солей, реакций, концентрацией питательных элементов. Приведем некоторые универсальные питательные смеси для песчаных и водных культур (соли, отмеченные звездочкой, лучше растворять отдельно, так как они образуют осадок).
Смесь Гельригеля (г/л): Ca(NO3)2 безводный* – 0,492 или Ca(NО3)2 ∙ 4Н2О – 0,708; FeCl3∙6Н2О – 0,025; КС1 – 0,075; КН2РО4* – 0,136; MgSO4 безводный – 0,060 или MgSO4∙7H2O – 0,123.
Смесь Кнопа (г/л): Ca(NO3)2 безводный* – 1,00 или Ca(NО3)2∙4Н2О – 1,44; FeCl3∙6H2О (5%-ный раствор) – 1 капля; KH2PO4*– 0,25; КС1 – 0,12; MgSО4 безводный – 0,25 или MgSО4 ∙7H2О – 0,51.
Смесь Прянишникова (г/л): NH4NО3 – 0,24; СаНРО4 – 0,172; FeCl3∙6Н2О – 0,025; CaSО4∙2H2О – 0,344; MgSО4 безводный – 0,060 или MgSО4∙7H2О – 0,123; КС1 – 0,160.
Смесь Белоусова для сахарной свеклы (г/л): Ca(NO3)2 –1,1; КН2РО4 – 0,36; К2НРО4 – 0,43; MgSO4 безводный – 0,054; FeCl3 – 0,010; NaCl – 0,1; Н3ВО3 – 0,005; MnSО4∙5H2О – 0,005.
Смеси Кнопа, Гельригеля составлялись главным образом эмпирически, Прянишникова, Белоусова, Ягодина – на основании теоретических предпосылок.
Главные отличия между питательными смесями состоят в выборе источников азота и фосфора, влияние которых на реакцию раствора должно быть уравновешено. Если в состав смеси входит аммонийная соль (физиологически кислая), то смесь со временем будет подкисляться, а если Ca(NO3)2 – подщелачиваться. Однозамещенные фосфаты (КН2РО, NaH2PO и др.) обладают буферным свойством против подщелачивания, а двухзамещенные [К2НРО4, Na2HPO4, СаНРО4, а также Са3(РО4)2] – против подкисления. Так, в смесь Гельригеля азот введен в форме Ca(NО3)2 – соли физиологически щелочной, а КН2РО4 служит буфером против подщелачивания.
Устойчивую реакцию среды сохраняют питательные смеси Прянишникова и Белоусова, включающие труднорастворимые соли. При использовании хорошо очищенной воды и питательных смесей, в состав которых первоначально не включены микроэлементы, в раствор добавляют микроэлементы. Растворы микроэлементов по Хоклэнду для универсальных питательных смесей готовят из 18 мл воды и следующих солей: Н3ВО3 – 11 г; МпС12∙5Н2О – 7; CuSO4∙5Н2О, ZnSO4, A12(SО4)3, NiSO4∙6Н2О – по 1 г; Co(NO3)2∙6Н2О, ТiО2 – по 1 г; LiCl, SnCl2∙2Н2О, Kj, KBr – по 0,5 г. Раствор микроэлементов добавляют по 1–1,5 мл к 1 л питательной смеси или песка.
В качестве водной культуры обычно используется дистиллированная вода и лишь в специальных опытах бидистиллированная. Вода по сравнению с песком более чистый субстрат, но опыты с водной культурой более трудоемки. Эту модификацию вегетационного опыта применяют при изучении периодичности питания растений (для определения оптимальных условий в разные периоды вегетации), особенностей развития корневых систем, влияния реакции и буферности питательной среды на развитие растений.
Опыты с водной культурой проводят в широкогорлых стеклянных или полиэтиленовых сосудах вместимостью 3–5 и более литров, закрытых пробками с отверстиями, в которых растения закрепляются с помощью ватных тампонов или других приспособлений. Крепится каркас, через него пропускают трубки для насыщения питательного раствора воздухом (рис. 15.10). Удобно закреплять растения в широких цилиндрах из пластмассы или других нержавеющих материалов с сетчатым дном, наполненных гравием или гранулированным полиэтиленом. Способы укрепления растений в водной культуре показаны на рис. 15.11. Сосуды наполняются водой на три четверти объема.
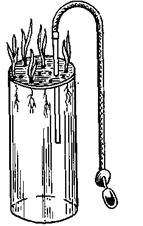
Рис. 15.10. Стеклянный вегетационный сосуд для водной культуры с трубкой и грушей для насыщения воды воздухом.
В опытах с водной культурой готовят питательные растворы высокой концентрации (в 100–200 раз выше, чем нормальной питательной смеси) и вносят их пипеткой или мерным цилиндром по схеме опыта. Семена проращивают в кюветах с песком, опилками, фильтровальной бумагой. Когда у растений образуются корни длиной 6–7 см, их закрепляют в крышке вегетационного сосуда. Во избежание перегрева сосудов и появления водорослей на сосуды надевают двойные чехлы (темные внутри и светлые снаружи).
Уход за растениями в опытах с водной культурой включает аэрацию питательного раствора. Резиновой грушей или воздуходувкой воздух продувают через воду один-два раза в сутки по 5–10 мин. Аэрация необязательна, если корни не полностью погружены в раствор (примерно на две трети). В соответствии со схемой опыта 3–4 раза за вегетацию питательные растворы меняют. 2–3 раза в неделю определяют реакцию питательного раствора и добавляют щелочные или кислотные растворы, чтобы значение рН находилось в нужных пределах. По мере испарения жидкости в сосуды доливают дистиллированную воду.

Рис. 15.11. Способ закрепления растений в водной среде:
1 – в момент посадки; 2 – после укоренения; 3 – кружок из парафинированного
дерева; 4 – питательная среда из фильтровальной бумаги.
Убирают и учитывают урожай в опытах с водной культурой так же, как с почвенной, но кроме основной и побочной продукции учитывается масса корней, анализируются части растений. Данные опыта статистически обрабатывают.
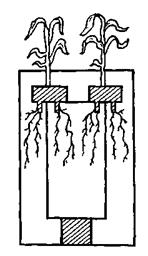
Метод изолированного питания, или разделенной культуры, используется при изучении значения разных солей в питании растений, передвижения элементов питания по корневой системе, выделения питательных элементов растениями, влияния внешних условий (температуры, реакции и др.) на питание растений, влияния взаимодействия двух или нескольких солей на усвоение элементов питания. В опытах с разделенной культурой растения одновременно выращивают на двух субстратах. Для этого один сосуд помещают в другой и заполняют их разными субстратами. Проростки растений закрепляют так, чтобы одна прядь корней растения получала питание из внешнего сосуда, другая – из внутреннего. Этот метод называют еще методом «всадника» – растение «сидит» на стенке внутреннего сосуда, как всадник на лошади (рис. 15.12). В опытах с изолированным питанием в качестве субстрата используются песчаные, песчано-почвенные, водные и другие культуры с нормальными или измененными питательными смесями.
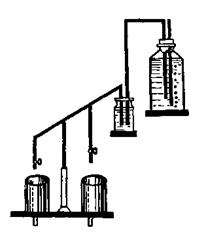
Метод текущей песчаной культуры, или протекающих растворов (капельная культура по Демолону), применяется, когда для исследования надо иметь постоянную концентрацию элементов или постоянное соотношение элементов, а также стабильную реакцию среды. В опытах с текущей песчаной культурой питательный раствор из бутылей вместимостью 16–20 л, помещенных на верхней полке установки, с помощью сифона подается в промежуточный сосуд, откуда он под постоянным давлением через сифоны с кранами или зажимами поступает в сосуды с растениями на нижней полке установки (рис. 15.13). Раствор проходит через песок, омывает корни и вытекает из отверстия в нижней части сосуда. При набивке сосудов питательная смесь в песок не вносится. Питательные смеси (Кнопа, Гельригеля и др.) разбавляют в 5–10 раз и пропускают через сосуды с растениями со скоростью 4 л в день – такой скорости достаточно, чтобы полностью обновить раствор в сосудах и поддерживать на одном уровне состав и реакцию питательной среды.
В опытах со стерильной культурой изучаются роль микроорганизмов в питании растений, корневые выделения, питание растений органическими соединениями. Эта модификация вегетационного опыта очень сложна, так как в сосудах субстрат и корневая система должны быть стерильными. Надземная часть растений находится в обычных условиях (рис. 15.14). Стеклянную посуду и песок стерилизуют при температуре 150 °С в течение двух часов, для обработки семян и материалов, не выдерживающих нагрева, используют антисептики (спирт и др.). Опыты со стерильной культурой ставятся редко, поэтому на технике их проведения мы останавливаться не будем.
Источники:
http://studme.org/292598/ekologiya/mineralnoe_pitanie
http://studopedia.ru/11_131798_osobennosti-metodiki-polevogo-opita-s-plodovo-yagodnimi-kulturami.html
http://helpiks.org/7-73726.html





