Лейкоантоцианы, танины – Фенольные соединения
Лейкоантоцианы, танины – Фенольные соединения
Фенольные соединения
Фенольные соединения широко распространены в растениях. Известно более двух тысяч различных представителей этой группы веществ. Все они содержат в молекуле ароматическое ядро, в котором один или больше атомов водорода замещены на гидроксильные группы.
Некоторые фенольные соединения принимают активное участие в метаболизме растений. Уже известные нам пластохиноны служат переносчиками электронов и протонов в электронтранспортной цепи хлоропластов. Убихиноны выполняют аналогичные функции в системе окислительного фосфорилирования, локализованной во внутренней мембране митохондрий. Важными фенольными производными являются жирорастворимые витамины, токоферолы, менахиноны и филлохиноны. Оксикоричные кислоты являются активаторами ростовых процессов у растений.
Другие разновидности фенольных соединений обладают Р-витаминной активностью (катехины, некоторые флавонолы) или окрашивают плоды, листья, лепестки цветков (антоцианы, флавоны и флавонолы). Некоторые фитоалексины, защищающие растения от патогенов, также относятся к производным фенолов. Полифенольные соединения служат веществами–антиоксидантами. Они быстро вступают во взаимодействие с кислородом и таким образом защищают от окисления другие вещества в тканях растений. Фенольные группировки способны также гасить свободнорадикальные реакции, происходящие в ходе окисления веществ. Полимерные фенольные соединения выполняют структурную и защитную функции (лигнин, дубильные вещества).
Различают три группы фенольных соединений: оксибензойные кислоты, оксикоричные кислоты и кумарины, флавоноидные соединения. При взаимодействии простых фенольных соединений образуются их полимерные производные: лигнин, дубильные вещества, меланины.
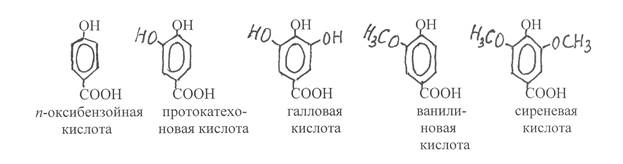
К важнейшим представителям оксибензойных кислот относятся n-оксибензойная, протокатеховая, галловая, ванилиновая и сиреневая кислоты:
Протокатеховая и галловая кислоты содержатся в растениях как в свободном, так и связанном состоянии, а n-оксибензойная, ванилиновая и сиреневая кислоты являются продуктами распада полимерного фенольного соединения – лигнина. Альдегидное производное ванилиновой кислоты ванилин в виде гликозида содержится в плодах ванили. Как вещество, обладающее приятным запахом, оно используется в кондитерской промышленности. Ванилин также определяет аромат коньяка. Он образуется при окислении кониферилового спирта, содержащегося в древесном материале дубовых бочек.
Оксикоричные кислоты встречаются в растениях как в свободном, так и связанном состояниях. Наибольшей биологической активностью обладают их цис-изомеры, которые активируют ростовые процессы. В связанном состоянии они могут своей карбоксильной группой образовывать сложные эфиры с шикимовой и хинной кислотами, а также некоторыми алифатичес-кими кислотами. Основные оксикоричные кислоты растений – n-оксикорич-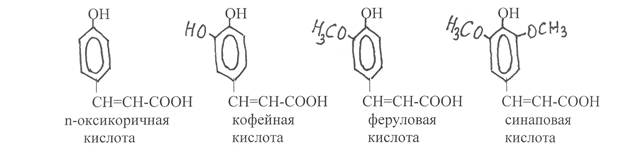
ная (n-кумаровая), кофейная, феруловая, синаповая кислоты:
Фенольные соединения
К фенольным соединениям ФС относится обширный класс циклических веществ, являющихся производными ароматического спир- та – фенола (С6Н5ОН). В молекуле фенольных соединений имеется ароматическое кольцо, содержащее одну или несколько гидроксильных групп. Фенольные соединения находятся в растениях, плодах и овощах преимущественно в виде гликозидов и реже в свободном виде [24].
Биосинтез фенольных соединений в растительной клетке происходит в протоплазме, в частности, в хлоропластах. Однако основная масса водорастворимых фенолов сосредоточена в вакуолях, ограниченных от цитоплазмы белково-липидной мембраной – тонопластом, который регулирует участие веществ, содержащихся в вакуолях, в метаболизме клетки. В животном организме фенольные соединения не синтезируются, а поступают с растительной пищей и участвуют в обменных процессах.
К гликозидам относятся разнообразные вещества, у которых какой-либо сахар (чаще – глюкоза, реже – другие моносахариды) соединен за счет гликозидного гидроксила с другими веществами, не являющимися сахарами (спиртами, альдегидами, фенолами, алкалоидами, стероидами и др.). Вторая часть молекулы гликозидов называется агликоном (не сахар).
От содержания и превращений фенольных соединений зависят цвет и аромат плодов, качество чая, кофе, вина. Многие фенолы обладают свойствами витамина Р и являются антиоксидантами.
Все фенольные соединения являются активными метаболитами клеточного обмена и играют важную роль в различных физиологических функциях растений, плодов, картофеля и овощей – дыхании, росте, устойчивости к инфекционным заболеваниям.
О важной биологической роли фенольных соединений свидетельствует их распределение в растительной ткани. Разные органы и ткани растений, плодов и овощей различаются не только количественным содержанием фенолов, но и качественным их составом.
В настоящее время известно более 2000 фенольных соединений, существенно различающихся по своим свойствам. В связи с этим важное значение имеет классификация фенольных соединений, представленная на рис. 3 .
Фенольные соединения условно разделяются на три основные группы [24]:
Мономерные фенольные соединения содержат одно ароматиче-ское кольцо и делятся на три подгруппы:
– соединения С6-ряда, состоящие из ароматического кольца без углеродных боковых цепей; к ним относятся гидрохинон, пирокатехин и его производные, гваякол, флороглюцин, пирогаллол. Все они содержатся в растениях главным образом в связанном виде;
– соединения с основной структурой С6-С1-ряда включают в себя группу фенолкарбоновых кислот и их производных – протокатеховую, ванилиновую, галловую, салициловую, оксибензойную и другие
кислоты; эти соединения встречаются в плодах и овощах в свободном виде;
– соединения с основной структурой С6-С3-ряда, состоящие из ароматического кольца и трехуглеродной боковой цепи, делятся на коричные кислоты, кумарины и производные последних: изокумарины, фурокумарины.
Кумарины рассматриваются как лактоны оксикоричных кислот. Наиболее распространенными коричными кислотами являются п-ку-маровая, кофейная, феруловая и синаповая.















Рис. 3. Классификация фенольных соединений
Фенолкарбоновые кислоты, обладая фенольными и кислотными группами, могут реагировать друг с другом с образованием соединений типа сложных эфиров, называемых депсидами. Если в реакции участвуют две фенолкарбоновые кислоты, то образуется дидепсид, если три – тридепсид и т.п. Соединения С6-С3-ряда участвуют в формировании аромата и вкуса плодов и овощей.
Димерные фенольные соединения имеют основную структуру с двумя ароматическими кольцами С6-С3-С6 и делятся на флавоноиды и изофлавоноиды (ротеноиды). Эти соединения наиболее широко распространены в природе, и многие из них принимают участие в формировании аромата и цвета растительных продуктов.
В зависимости от структуры связующего трехуглеродного фрагмента в молекуле и степени окисленности флавоноиды подразделяются на катехины, лейкоантоцианы, флаваноны, флаванонолы, антоцианы, флавоны, флавонолы и другие (см. рис. 3). Наиболее восстановленные соединения – катехины, наиболее окисленные – флавонолы.
Катехины – бесцветные соединения, легко окисляются, в результате чего приобретают разную окраску. Например, различный цвет чая (черный, красновато-коричневый, желтый) обусловлен степенью окисления катехинов, содержащихся в чайном листе. Существует несколько форм катехинов: катехин, галлокатехин, галлокатехингаллат и другие. Каждый катехин может существовать в виде четырех оптических изомеров, различающихся по направлению и величине угла вращения: (+)-катехин, (-)-катехин; (+)-эпикатехин, (-)-эпикатехин. Кроме того, для каждого катехина известны два рацемата – смесь, лишенная оптической активности: (+)-катехин и (+)-эпикатехин. Все они отличаются по физическим свойствам и биологическому действию. Например, высокой Р-витаминной активностью обладает (-)-эпикатехин.
В плодах и овощах катехины могут присутствовать в свободном и связанном состоянии (в составе полимерных форм). Много катехинов содержится в винограде, айве, черной смородине, яблоках, черноплодной рябине, косточковых плодах и ягодах.
Катехины хорошо растворимы в воде, имеют слабый вяжущий вкус, легко окисляются на свету, при нагревании, особенно в щелочной среде под действием окислительных ферментов (фенолоксидазы и пероксидазы). Продукты окисления – хиноны – и полимеризации катехинов – флобафены – придают плодам и овощам при термической и механической обработке темную окраску.
Окисление фенольных соединений может быть обратимым и необратимым. Этот процесс происходит и в здоровых, неповрежденных растительных клетках, но ткань их при этом не темнеет. Это обусловлено тем, что через тонопласт в цитоплазму поступает строго ограниченное количество фенолов, рассчитанное на тот ферментативный аппарат, который имеется в цитоплазме.
При окислении в здоровой клетке часть фенолов окисляется до карбоновых кислот и в качестве конечных продуктов окисления образуются СО2 и Н2О.
Часть же промежуточных продуктов окисления фенолов с помощью ферментов фенолоксидазы и пероксидазы, а также восстановителей, вновь восстанавливается до исходных соединений.
В поврежденных клетках в контакте с о-фенолоксидазой оказывается сразу большое количество фенолов и поэтому восстановления не происходит, а образующиеся хиноны необратимо конденсируются как между собой, так и с аминокислотами с образованием коричневых и красных аморфных веществ – флобафенов.
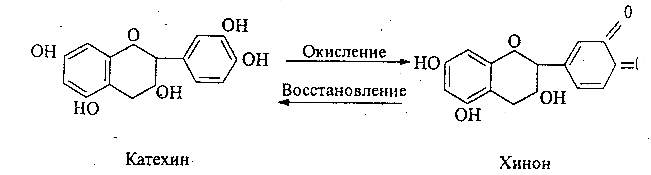
Например, причиной потемнения очищенных и нарезанных клубней картофеля является окисление аминокислоты фенольного ха-рактера – тирозина ( a-оксифенилаланин). Тирозин окисляется до диоксифенилаланина, который превращается в хинон, образующий красные гетероциклические соединения. Хиноны полимеризуются и превращаются в продукты темного цвета – меланины.
Образование темноокрашенных веществ при хранении очищенного картофеля может происходить в результате окисления другого вещества фенольной природы – хлорогеновой кислоты. Потемнение внутренней сердцевины картофеля связано с окислением хлорогеновой кислоты, а внешней сердцевины – с окислением тирозина.
Предотвратить окисление фенолов очень важно при производстве крахмала, так как образующийся при измельчении картофеля клеточный сок содержит наряду с другими веществами тирозин. Последний легко окисляется, что вызывает потемнение крахмала, ухудшение его качества. Быстрое отделение клеточного сока от крахмала на центрифуге позволяет получить крахмал высокого качества.
Для предотвращения потемнения плодов и овощей при чистке, резке и дроблении применяют различные вещества (диоксид серы, аскорбиновую, лимонную кислоты и др.), а также тепловую обработку для инактивации фенолоксидаз, пероксидаз и каталазы.
На предприятиях общественного питания применяется сульфитация очищенного картофеля, заключающаяся в обработке клубней слабым раствором диоксида серы (0,1-0,2%).
Лейкоантоцианы, флаваноны и флаванонолы – это бесцветные фенольные соединения. Лейкоантоцианы изменяют окраску в зависимости от температуры. Так, при 135°С они имеют желтый цвет, при 165°С – винно-красный, выше 225°С – сине-серый, при 260°С – черный. При нагревании они превращаются в лейкоантоцианидины. Лейкоан-тоцианы в значительном количестве содержатся в плодах и овощах, придавая некоторым из них терпкий вкус.
Флаваноны и флаванонолы в свободном виде встречаются редко, чаще в форме гликозидов. Богаты ими цитрусовые плоды, в которых содержатся нарингенин, гесперидин и эридиктол.

Лейкоантоцианы Флаваноны Флаванонолы
Флавоновые пигменты – это окрашенные фенольные соединения: антоцианы, флавоны и флавонолы. Эти фенольные гликозиды хорошо растворимы в воде, обладают бактерицидными свойствами. Они содержатся во многих плодах и овощах, отличаются повышенной окислительной способностью. Антоцианы имеют фиолетовый цвет, флавоны и флавонолы – желтый.
Антоцианы. Они представляют собой гликозиды, в которых остатки сахаров (глюкозы, галактозы и рамнозы) связаны с окрашенными агликонами, принадлежащими к группе антоцианидинов. Раз- личают шесть антоцианидинов, составляющих агликоны антоцианов – пеларгонидин, цианидин, пеонидин, дельфинидин, петунидин, мальвидин. В зависимости от наличия этих соединений плоды имеют разную окраску.
Наиболее распространен цианидин, он обнаружен в яблоках, землянике, сливах и в других плодах. В некоторых плодах антоцианы находятся только в кожице (виноград, слива), в других – в кожице и мякоти (малина, черника, смородина).
В зависимости от рН окраска антоцианов может меняться от кра-сной до синей и фиолетовой (в кислой среде – красные, в щелочной -синие). Антоцианы с ионами К, Nа, Fе и других металлов дают соединения синего цвета.
Флавоны– это пигменты, имеющие желтую окраску; содержат-ся во многих плодах и овощах. Флавоны являются предшественниками антоцианов.
Флавонолы отличаются от флавонов наличием гидроксильной группы и обладают сильными бактерицидными свойствами. Чаще всего в плодах и овощах из флавонолов распространены кверцетин, кемферол, рутин и мирицетин. Кверцетин – самый распространенный флавонол придает золотистый цвет кожице лука, облепихе.

Антоцианы Флавоны Флавонолы
Полимерные фенольные соединения делятся на гидролизуемые и негидролизуемые конденсированные дубильные вещества.
Гидролизуемые вещества – танины – это сложные эфиры моносахаридов (глюкозы) и фенольных кислот (галловой, эллаговой, протокатеховой, кофейной, хлорогеновой).
Танины легко подвергаются гидролизу, распадаясь на более простые соединения. Танины взаимодействуют с солями тяжелых металлов, вызывая изменения цвета продуктов переработки плодов и овощей.
Гидролиз дубильных веществ приводит к ослаблению или исчезновению терпкого вкуса плодов и к накоплению сахаров, что улучшает вкус. Кроме того, продукты распада танинов – фенольные кислоты – усиливают защитные свойства плодов и овощей.
Гидролиз дубильных веществ наблюдается при дозревании плодов и овощей, нанесении механических повреждений и поражении микроорганизмами. Чаще всего при этом накапливается хлорогеновая кислота.
Негидролизуемые вещества состоят из остатков катехинов и лей-коантоцианов и образуются при окислительной конденсации этих мономеров. Конденсация флавоноидов происходит при нагревании с разбавленными кислотами. Конденсированные дубильные вещества с солями железа дают темно-зеленое окрашивание.
Конденсированные дубильные вещества содержат мало углеводов и образуют в присутствии минеральных кислот нерастворимые аморфные соединения – флобафены.
Существенным качественным и количественным изменениям подвергаются фенольные соединения в плодах и овощах в процессе созревания и хранения. Количество их уменьшается за счет гидролиза и использования на дыхание. В то же время при созревании плодов и овощей такие фенолы, как антоцианы, флавоны, флаваноны, флавонолы синтезируются и улучшают цвет продуктов. В процессе хранения плодов и овощей происходит взаимопревращение фенольных соединений. Так, при гидролизе танина образуются фенолокислоты, при конденсации катехинов – конденсированные дубильные вещества.
77.243.189.108 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Динамика накопления катехинов щавелем курчавым (rumex crispus L. ) суперпродуцентом фенольных соединений проантоцианидинового ряда Текст научной статьи по специальности «Биологические науки»
Аннотация научной статьи по биологическим наукам, автор научной работы — Федураев Павел Владимирович, Чупахина Галина Николаевна, Скрыпник Любовь Николаевна
Изучена сезонная динамика накопления катехинов в надземной части щавеля курчавого с учетом эколого-фитоценотических условий среды. Установлено, что максимальное содержание данного класса фенольных соединений наблюдалось в фазы завершения цветения и начала плодоношения. Выявлена прямая корреляционная зависимость в содержании лейкоантоцианов и катехинов . Показан светозависимый характер накопления катехинов .
Похожие темы научных работ по биологическим наукам , автор научной работы — Федураев Павел Владимирович, Чупахина Галина Николаевна, Скрыпник Любовь Николаевна
Текст научной работы на тему «Динамика накопления катехинов щавелем курчавым (rumex crispus L. ) суперпродуцентом фенольных соединений проантоцианидинового ряда»
Химия растительного сырья. 2011. №4. С. 205-208.
ДИНАМИКА НАКОПЛЕНИЯ КАТЕХИНОВ ЩАВЕЛЕМ КУРЧАВЫМ (RUMEX CRISPUS L.) – СУПЕРПРОДУЦЕНТОМ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ ПРОАНТОЦИАНИДИНОВОГО РЯДА
© П.В. Федураев , Г.Н. Чупахина, Л.Н. Скрыпник
Российский государственный университет им. Иммануила Канта,
Калининград, ул. Университетская, 2, 236040 (Россия), e-mail: pavelf15@mail.ru
Изучена сезонная динамика накопления катехинов в надземной части щавеля курчавого с учетом эколого-фитоценотических условий среды. Установлено, что максимальное содержание данного класса фенольных соединений наблюдалось в фазы завершения цветения и начала плодоношения. Выявлена прямая корреляционная зависимость в содержании лейкоантоцианов и катехинов. Показан светозависимый характер накопления катехинов.
Ключевые слова: щавель курчавый, катехины, лейкоантоцианы, онтогенез, свет, температура,
Катехины являются достаточно обширной группой растительных органических соединений: число известных флаван-3-олов превышает 1000, Эффекты данного класса фенольных соединений обнаруживаются на всех уровнях организации биосистем – от молекулярного до экосистемного [1, 2],
Одна из важнейших функций катехинов – участие в окислительно-восстановительных процессах в качестве эффективных антиоксидантов [3], Ярко выраженная экологическая, главным образом защитная, роль фенольных соединений должна учитываться и позволяет предположить, что это достаточно тонкий механизм, работающий на уровне индивидуальных растений и микроусловий среды [4],
В последнее время становятся актуальными исследования, посвященные поиску растений с высоким содержанием физиологически активных веществ, в том числе биофлавоноидов. Согласно литературным данным [5], растения рода Rumex L. (щавель) семейства Polygonaceae Juss, (гречишные) отличаются более высоким содержанием фенольных соединений проантоцианидинового ряда по сравнению с дикорастущими растениями луговых фитоценозов средней полосы России. Кроме того, количество фенолов, флаван-3-олов в частности, синтезируемых в растениях, зависит от их физиологического состояния и условий произрастания [6],
В связи с этим целью данного исследования явилось изучение динамики накопления катехинов щавелем курчавым с учетом эколого-фитоценотических условий Калининградской области.
В качестве объекта исследования был выбран щавель курчавый (Rumex crispus L,), являющийся одним из доминирующих видов на луговых фитоценозах Калининградской области.
Щавель курчавый (лат. Rumex crispus L.) – представитель семейства Гречишные (лат. Polygonaceae Juss,), Стебель прямой, голый, крупно, но неглубоко бороздчатый, 40-150 см. Листья ланцетные или продолговатоланцетные, длинно заостренные, к основанию клиновидно суженные, по краям сильно волнистые, пластинка 15-25 см длиной, 1,5-4 см шириной; черешки немного короче пластинки; верхние листья мельче, черешки короче. Цветки мелкие, красновато-зеленые, собраны в длинную, узкую, густую метелку. Цветет в июне-июле. Плод – трехгранная семянка [7],
* Автор, с которым следует вести переписку,
Сбор растительного материала осуществлялся в окрестностях Светлогорска (приморская зона Калининградской области). Одновременно проводились измерения температуры воздуха и уровня освещенности.
В растениях определялось количественное содержание катехинов и лейкоантоцианов спектрофотометрическим методом [8, 9]. Анализы выполнялись в трех биологических повторностях, полученные данные обработаны статистически с использованием пакета электронных таблиц Microsoft Exel и представленої в виде средних арифметических значений с указанием среднего квадратического отклонения [8].
Анализ динамики накопления катехинов в вегетативных и генеративных частях щавеля курчавого показал, что максимальное содержание флаван-3-олов в генеративных частях наблюдалось в середине июля, в фазе плодоношения (рис. 1), и составило 639,93 мг/100 г. Точка минимума приходилась на вторую половину июля (завершение плодоношения), когда уровень катехинов равнялся 262,74 мг/100 г (рис. 2).
График динамики содержания флаван-3-олов в вегетативных частях имел выраженный восходященисходящий характер: максимум был отмечен в начале июля (завершение цветения, начало плодоношения) и составил 391,25 мг/100 г, а минимум (44,93 мг/100 г) пришелся на начало цветения (рис. 2).
В ходе исследования установлено, что уровень катехинов в генеративной и вегетативной частях растений различался примерно в 2 раза.
Наряду с катехинами в надземной части щавеля курчавого анализировалось содержание лейкоантоцианов (рис. 3, 4).
Исследования показали (рис. 3), что общий уровень лейкоантоцианов в генеративных частях растений повышался вплоть до середины июля с некоторым снижением содержания в конце июля (фаза плодоношения). Данное повышение отразилось и на уровне катехинов, который также повышался до середины июля и имел некоторое снижение в конце июля. Далее содержание лейкоантоцианов повышалось и достигало максимума в начале августа (завершение плодоношения). Вслед за содержанием флаван-3,4-диолов повышался и уровень флаван-3-олов. Позднее содержание флаван-3,4-диолов оставалось постоянным, что отразилось и на концентрации катехинов.
Рис. 1. Фенологические фазы щавеля курчавого в вегетационной период 2009 г.: цветение, 1=1 плодоношение, НИ увядание
Рис. 2. Динамика накопления катехинов в Рис. 3. Сезонная динамика содержания
надземной части щавеля курчавого приморской лейкоантоцианов и катехинов в генеративной
зоны Калининградской области части растений щавеля курчавого
Исследование динамики накопления лейкоантоцианов и катехинов вегетативной части щавеля курчавого показало, что увеличение содержания лейкоантоцианов происходило до второй половины июня (фаза цветения), которое сменялось снижением уровня флаван-3,4-диолов вплоть до начала августа (завершение плодоношения). Однако уровень катехинов нарастал до начала июля и достигал максимума в начале плодоношения, после чего прослеживалась общая тенденция к снижению уровня катехинов вегетативной части данного растения (рис. 4).
Исследования зависимости накопления катехинов от света и температуры позволили выявить следующую закономерность: в моменты более интенсивного светового воздействия, которое наблюдалось в конце июля – начале августа, уровень фенольных соединений, и в особенности в генеративной части щавеля курчавого, значительно увеличивался (рис. 5). При этом корреляционной связи между уровнем катехинов и изменением температуры выявить не удалось.
Рис. 4. Сезонная динамика содержания лейкоантоцианов и катехинов в вегетативной части растений щавеля курчавого
Изучение динамики накопления флавоноидов имеет как теоретическое, так и практическое значение. С теоретической точки зрения изучение динамики важно для выяснения биохимической роли флавоноидов в жизни растения. Практические исследования связаны с изучением природных фенольных соединений в качестве перспективных веществ для получения биологически активных препаратов и лекарственных средств.
В нашей работе исследована динамика накопления катехинов и лейкоантоцианов щавелем курчавым как суперпродуцентом фенольных соединений проантоцианидинового ряда.
Статистический анализ экспериментальных данных показал положительную корреляционную связь между уровнем накопления лейкоантоцианов и содержанием катехинов в растениях (г = 0,75 – для генеративной части, г = 0,60 -для вегетативной части).
Лейкоантоцианы, будучи предшественниками катехинов, напрямую влияют на концентрацию этих соединений [4, 10]. Уровень флаван-3-олов значительно превышал содержание лейкоантоцианов в изученных растениях. Данное явление может быль связано с образованием димерных или более олигомерных проантоцианидинов, с последующим их преобразованием в дубильные вещества, которые могут рассматриваться как продукт конденсации катехинов [1, 4]. Наряду с флаван-3,4-диолами катехины являются родоначальниками дубильных веществ конденсированного ряда. Стоит отметить, что данные конденсированные формы соединений способны к накоплению [4].
Кроме того, на уровень флаван-3-олов влияют и динамические факторы внешней среды, такие как температура и освещенность. Синтез фенольных соединений в значительной мере обусловлен влиянием света, особенно в периоды сильной инсоляции [11]. Результаты проведенных нами исследований свидетельствуют о зависимости биосинтеза катехинов от интенсивности инсоляции.
Рис. 5. Изменение температуры и интенсивности света в период сбора растительных проб
Установлено, что максимальное содержание катехинов в надземных частях щавеля курчавого наблюдалось в фазы завершения цветения и начала плодоношения и составило 639,93 мг/100 г для генеративной части и 391,25 мг/100 г для вегетативной. Выявлена прямая корреляционная связь между содержанием лейкоантоцианов и катехинов: повышение уровня флаван-3,4-диолов сопровождалось возрастанием уровня флаван-3-олов, Кроме того, результаты проведенных исследований свидетельствуют о зависимости биосинтеза катехинов от интенсивности инсоляции.
1, Красильникова Л.А., Авксентьева О.А., Жмурко В.В, Биохимия растений, М., 2004, 224 с,
2, Костюк В.А., Потапович А.И. Биорадикалы и биоантиоксиданты. Мн., 2004, 179 с.
3, Кукушкина Т.А,, Седельникова Л.Л, Динамика накопления запасных веществ в клубнелуковицах Crocus Alatavicus и Gladiolus Hybridus // Химия растительного сырья, 2010, №2, С. 123-126,
4, Запрометов М.Н. Фенольные соединения: распространение, метаболизм и функции в растениях, M., 1993, 272 с.
5, Высочина Г.И. Фенольные соединения в систематике и филогении семейства гречишных. Новосибирск, 2004, 240 с.
6, Запрометов М.Н, Специализированные функции фенольных соединений в растениях // Физиология растений, 1993, Т. 40, №6, С. 921-931,
7, Губанов И.А., Киселева К.В., Новиков B.C., Тихомиров В.Н. Определитель сосудистых растений центра Европейской России, 2-е изд., дополн. и перераб. М., 1995, 559 с.
8, Чупахина Г.Н., Масленников П.В, Методы определения витаминов : практикум, Калининград, 2004, 36 с.
9, Методические рекомендации по анализу плодов на биохимический состав, Ялта, 1982, 28 с.
10, Меньшикова Е.Б., Ланкин В.З., Зеньков Н.К. и др. Окислительный стресс, Прооксиданты и антиоксиданты / под ред. Е.Б. Меньшикова. М., 2006, 556 с.
11, Масленников П.В., Чупахина Г.Н, Влияние света различной интенсивности на биосинтез антоцианов // Новые и нетрадиционный растения и перспективы их использования : матер, IV междунар. симпозиума, Пущино, 2001, С. 522-524,
Источники:
http://studopedia.ru/1_121338_fenolnie-soedineniya.html
http://studopedia.ru/16_108691_fenolnie-soedineniya.html
http://cyberleninka.ru/article/n/14655079




