Коллоидные явления в винах
Коллоидные явления в винах
Коллоидные явления в винах





Оклейка вина
Оклейкой называется операция осветления вина, при которой в него вводят гидрофильные коллоиды (желатин, рыбий клей и другие), вступающие во взаимодействие с коллоидами .вина. Нерастворимые соединения, получающиеся в результате взаимодействия белковых и дубильных веществ, образуют хлопья, которые, оседая на дно, увлекают с собой взвешенные в вине мелкие частицы и осветляют его. Таким образом, в процессе оклейки наблюдается изменение золей как коллоидной системы, связанное с увеличением дисперсности твердой фазы, проходящим в две стадии: укрупнение частиц (собственно коагуляция) и выделение твердой фазы в осадок (седиментация).
В красных винах, богатых танином, хлопья появляются через несколько минут после прибавления желатина. Они быстро увеличиваются в размере, приобретают более или менее интенсивную окраску, образуют своего рода сетку, которая, оседая на дно, захватывает мелкие хлопья и другие взвешенные в вине частицы.
В белых винах, значительно более бедных танином, хлопья образуются через несколько часов, а иногда и дней после оклейки.
Скорость образования танатов, величина хлопьев и скорость их оседания тем больше, чем выше концентрация танина и белковых веществ.
Хлопья, образуемые в белых винах рыбьим клеем, появляются часто лишь через 3-4 дня после оклейки: они очень рыхлы, имеют большие (размеры, оседают равномерно и дают объемистые осадки.
Казеин, который коагулирует под действием кислот, дает хлопья, одинаковые в красных и белых винах.
Теоретические основы явлении, которые наблюдаются при оклейке, вытекают из наших современных представлений об окислительных процессах, а также о физико-химических свойствах коллоидных веществ вина.
По исследованиям Харина и Нечаева, в винах различных типов содержится от 3 до 7 г коллоидов на 1 л. Несмотря на сравнительно небольшое количество коллоидных веществ в вине, влияние их на осветление весьма значительно. На стойкость вина как коллоидного раствора, а отсюда и на образование мути и осадка оказывает влияние соотношение между гидрофильной, обратимой фракцией коллоидов и необратимой, менее гидрофильной. Вина, содержащие недостаточное количество стойких обратимых коллоидов, легко мутнеют. С увеличением концентрации коллоидов возрастает вязкость, вследствие чего при оклейке коллоиды замедляют оседание взвешенных частиц я затрудняют очистку.
Роль танина, имеющегося в вине, а также добавляемого часто при оклейке, заключается в переводе гидрофильных коллоидов в гидрофобные.
Если в синтетическую среду, сходную по составу с вином, но без минеральных солей, вводят белковые вещества (желатин, рыбий клей) и танины, то явления, сходного с оклейкой (хлопьеобразования и т. п.), не произойдет. Раствор остается прозрачным или слегка мутнеет. Если добавить в этот раствор соли натрия, кальция или магния в той же; концентрации, в которой они находятся в вине, наступит быстрое помутнение, которое будет прогрессивно увеличиваться. Однако осветление будет происходить очень медленно. Повышение температуры еще более его замедляет. Быстрое оседание взвешенных частиц и осветление раствора, сходное с происходящим при оклейке вина, получается, если добавить очень небольшое количество трехвалентного железа. Повышение температуры до 25° в этом случае не препятствует оседанию. Таким образом, коагулирующее действие солей трехвалентного железа несравненно более значительно, чем других солей металлов, даже если железо взято в меньшей концентрации, чем соли натрия, кальция или магния.
То же действие трехвалентного железа, ускоряющего коагулирование, наблюдается при оклейке белых вин желатином. Чтобы убедиться в этом, достаточно удалить трехвалентное железо из вина желтой кровяной солью или путем восстановления трехвалентного железа. Восстановить трехвалентное железо можно действием на вино гидросульфита или оставив вино в покое без доступа воздуха на более или менее длительный срок, в зависимости от температуры. После этого коагуляция в вине и образование мути при оклейке происходит нормально, оседание же взвешенных частиц сильно замедляется или даже совсем не происходит. Особенно резко это проявляется при повышении температуры (около 25°).
Винодельческая практика показывает, что в белых винах, проветренных перед оклейкой, оседание и осветление происходит значительно быстрее и полнее, чем при оклейке вин, находившихся длительное время в покое без доступа воздуха. Причиной этого является не непосредственное действие кислорода, а образование в результате окисления трехвалентного железа.
При оклейке белых вин желатином в условиях повышенной температуры наличие трехвалентного железа необходимо.
Однако, как показывают опыты 167, осветление вина оклейкой может быть проведено и в отсутствии катионов железа при условии тщательного подбора соотношения оклеивающих компонентов. Структура осаждающихся при этом танатов пылевидная и мелкохлопьевидная. Время, потребное для осветления в этом случае, значительно более продолжительно, что является лишним подтверждением той важной роли, которую играют катионы трехвалентного железа при оклейке вина.
Если присутствие в винах солей трехвалентного железа оказывает стимулирующее действие на процесс оклейки, то наряду с этим в вине часто содержится ряд веществ, которые обладают противоположными свойствами.
Некоторые вина содержат вещества (камеди, декстран), которые играют роль защитных коллоидов и препятствуют осаждению других коллоидов [64]. Вина эти трудно поддаются оклейке. Молодые, нефильтрованные вина часто невозможно осветлить, пользуясь оклейкой: по существующему среди виноделов выражению, они «не берут клея». Однако это происходит не потому, что в них не хватает танина, а вследствие избытка в них слизистых веществ, играющих роль защитных коллоидов. Различные оклеивающие вещества в этих случаях ведут себя неодинаково. Желатин значительно более чувствителен к этим явлениям, чем казеин и особенно рыбий клей.
Если вина, содержащие коллоиды и плохо поддающиеся оклейке, предварительно подвергнуть фильтрованию, то хлопьеобразовавие и осветление в них происходят несравненно лучше, и процесс оклейки протекает более нормально. Это объясняется тем, что при фильтровании задерживается значительная часть защитных коллоидов. Вполне нормально оклейка протекает после фильтрации вина через ультрафильтр. Те же результаты получаются при повторной оклейке этих вин, так как первая оклейка удаляет значительную часть коллоидов (например декстран), играющих защитную роль.
Искусственное добавление в вино камеди препятствует осаждению желатина и осветлению вина. Небольшие количества камеди (50 мг/л) замедляют осаждение, а более значительные количества (500 мг/л) уменьшают мутность вина. На этом основано применение защитных коллоидов (растительных камедей) для достижения стабильной прозрачности вин (Нечаев).
Процесс оклейки основан на взаимодействии вводимых в вило оклеивающих материалов с коллоидными веществами вина. Проведенное изучение [67] зависимости состава танатов желатина от концентрации раствора желатина показало, что с увеличением количества танина, вводимого в раствор желатина, количество танина, вступающего во взаимодействие с желатином, увеличивается и достигает максимума при отношении танина к желатину, равном 7:8.
Дальнейшее увеличение количества танина, вводимого в раствор, не вызывает заметного увеличения связывания танина желатином. Анализом состава танатов рыбьего клея установлено, что по способности связывать танин рыбий клей почти ничем не отличается от желатина. Исходя из современных представлений о белках, как амфотерных электролитах, обладающих большим молекулярным весом и способностью образовывать истинные термодинамически устойчивые растворы, можно считать, что они вступают в химическое взаимодействие с танидами, образуя химические соединения оолеобразного характера – танаты [67].
Основными факторами, определяющими состав танатов, являются: концентрация тавидов в растворе, рН среды, длительность выдержки и содержание спирта в вине. При оклейке оказывают влияние также температура и сроки предварительного нагревания растворов белковых оклеивающих веществ.
Танаты подобно белкам обладают амфотерными свойствами и, как белковые вещества, могут быть заряженными как положительно, так и отрицательно, в зависимости от рН среды. Изо-электрические точки танатов лежат в стороне более низких значений рН, по сравнению с изоэлектрическими точками белков, принимавших участие в образовании танатов. Танаты, не обладая постоянством состава, не имеют также и постоянных изо-электрических точек. Чем выше содержание в среде кислот, солей и дубильных веществ, тем значительнее сдвиг рН изоэлектрической точки танатов влево, т. е. в более кислую среду.
Исходя из приведенных выше теоретических предпосылок, механизм процесса оклейки можно представить в следующем виде.
Электрические заряды частиц коллоидов пектиновых веществ отрицательны, а желатина и других белковых веществ, не коагулированных танином в растворе, имеющем рН 3 (средний для вина), положительны.
Танаты в состоянии, близком к изоэлектрическому, агрегируются и выпадают в осадок. На агрегацию частиц танатов оказывают влияние анионы кислот, а также катионы поливалентных металлов (железо, алюминий, кальций и другие). Из анионов, находящихся в вине, наибольшим агрегирующим свойством обладают анионы серной кислоты, из катионов – трехвалентвое железо и алюминий. Этиловый спирт на агрегативную устойчивость танатов не оказывает влияния.
Танаты, находясь в растворе, представляют собой полидисперсную систему, частицы которой обладают значительно большим молекулярным весом, чем частицы белка, участвовавшего в образовании танатов. Средневесовой молекулярный вес танатов с течением времени увеличивается и зависит от рН среды и наличия в ней электролитов.
Наименьшим молекулярным весом обладают танаты при наивысшей зарядности. Понижение зарядности частиц танатов вызывает их укрупнение и выделение из раствора в виде твердой фазы, образование золя и, наконец, коагуляцию и выпадение в осадок.
Помимо взаимодействия танина с белковыми веществами, во время оклейки происходит прямое действие некоторых элементов вина на нешагулировавные белковые вещества. Взвешенные частицы, образующие в вине муть, не остаются пассивными, а коагулируют с белковыми веществами, некоагулированными танинами, и увеличивают плотность хлопьев, а также содействуют более быстрому их оседанию. Этому способствуют адсорбирующие свойства хлопьев, обладающих большой поверхностной энергией.
Прибавление в трудно осветляемые вина до оклейки небольшого количества (примерно, 20% от количества оклеивающего вещества) диатомита или бентонита, обладающих также большой адсорбирующей способностью, ускоряет и улучшает осветление.
При оклейке не обязательно, чтобы белковые вещества, введенные в вино, полностью коагулировали и выпали в осадок. Последнее происходит в том случае, если вино содержит значительный избыток танина, например, при оклейке красных вин, которые содержат несколько граммов (7 г и выше в кахетинских винах) танина в 1 л и в которые задают нормально 0,1 гл желатина. Наоборот, при оклейке белых вин, нередко содержащих танина всего около 0,1 г в 1 л и меньше, во многих случаях некоторая часть белковых веществ остается в растворе, причем в вине, даже если оно вполне прозрачно, одновременно находятся танин и белковые вещества. При добавлении танина в этом случае происходит помутнение. Такое явление в практике называют переоклейкой. Переоклейка бывает тем значительнее, чем более введено в вино белковых веществ и чем меньше содержится в нем танина. Такие случаи чаще всего наблюдаются при оклейке белых вин желатином.
Переоклейка, которую виноделы часто не замечают, – крайне опасное явление и служит одной из причин помутнения вин в торговой сети.
Чем выше температура при оклейке вина и чем больше его кислотность, тем значительнее опасность получить переоклеенное вино. Уменьшение истинной кислотности (повышение рН) и понижение температуры вызывают эффект, аналогичный тому, который получается при добавлении танина, т. е. образование мути в вине. Помутнение, иногда очень значительное, происходящее при понижении температуры, полностью исчезает при легком подогревании вина до 25-30°. Избыток желатина в вине всегда можно обнаружить, добавляя в вино танин (2 г/л) или устанавливая температуру ниже 0°. Практически при оклейке белых вин желатином в условиях повышенной температуры очень трудно избежать переоклейки даже в том случае, если танин находится в избытке.
Во всех случаях при оклейке белых вин надо избегать введения желатина больше, чем 0,5-0,8 г/дкл. При осветлении белых вин рыбьим клеем переоклейка – редкое явление, что объясняется прежде всего тем, что его берут всегда значительно меньше, чем желатина. Альбумин также редко дает переоклейку, так как, требуя для хлопьеобразования значительного избытка танина, он не остается в вине некоагулированым. Казеин очень хорошо коагулирует в винах, бедных танином, и дает муть, но образование хлопьев и осветление происходят только в присутствии избытка танина.
Повышение кислотности увеличивает количество белковых веществ, остающихся в растворе, и способствует переоклейке. Казеин менее других оклеивающих белковых веществ реагирует на кислотность, поэтому очень кислотные вина рекомендуется оклеивать казеином.
Наряду с кислотностью на оклейку вина действует также температура. Более низкая температура способствует хлопьеобразованию и осветлению; повышенная температура, наоборот, затрудняет нормальное проведение оклейки. Наиболее чувствителен к влиянию температуры желатин.
Как правило, при повышенной температуре осадки образуются более плотные, -менее хлопьеобразные и более окрашенные.
Общие выводы, которые можно сделать о влиянии различрных факторов на хлопьеобразование при оклейке белковыми веществами, таковы: недостаток танина, избыток белковых веществ, присутствие защитных коллоидов, отсутствие трехвалентного железа, некоторое повышение истинной кислотности и температуры действуют неблагоприятно на процесс хлопьеобразования при оклейке и осветлении вина.
При осветлении вин веществами минерального происхождения (бентониты, каолин) явления переоклейки не наблюдается.
Электрокинетические явления
Различают 4 вида электрокинетических явлений: электрофорез, электроосмос, потенциал протекания (течения), потенциал седиментации (оседания).
Под действием внешнего электрического поля наблюдаются два явления:
1. перемещение частиц дисперсной фазы относительно неподвижной дисперсионной среды – электрофорез.
2. перемещение дисперсионной среды относительно неподвижной дисперсной фазы – электроосмос.
Явления, обратные электрофорезу и электроосмосу.
1. Возникновение разности потенциалов при перемещении дисперсной фазы относительно неподвижной дисперсионной среды – потенциал седиментации (оседания).
2. Возникновение разности потенциалов при перемещении дисперсионной среды относительно неподвижной дисперсной фазы – потенциал протекания.
Причиной электрокинетических явлений является образование двойного электрического слоя и, как следствие, наличие электрического заряда, как у частиц дисперсной фазы, так и у частиц дисперсионной среды.
Значение электрофореза, электроосмоса
Электрофорез используют в клинических исследованиях для диагностики многих заболеваний, для разделения аминокислот, нуклеиновых кислот, антибиотиков, ферментов, форменных элементов крови, для определения чистоты белковых препаратов, для введения лекарственных препаратов.
Кроме того в медицине электрофорез применяют для введения лекарственных препаратов. На кожу пациента накладывают тампон, смоченный раствором лекарственного препарата, а сверху электроды, к которым приложен низкий, безопасный для организма потенциал. Частички лекарственного препарата под действием электрического поля переходят в ткани организма.
Электроосмос используют для обезвоживания различных пористых материалов. Влажную массу помещают между электродами, а вода под действием электрического поля в зависимости от структуры ДЭС перемещается к одному из электродов и собирается в специальные емкости.
Скорость электрофореза (электрофоретическую активность) рассчитывают по уравнению Гельмгольца-Смолуховского:

U – скорость электрофореза (электрофоретическая подвижность)
ε – диэлектрическая проницаемость среды
ξ – электрокинетический потенциал
H – напряженность электрического поля
η – вязкость среды
Напряженность электрического поля выражается отношением разности потенциалов к расстоянию между электродами:


Устойчивость дисперсных систем
Под устойчивостью дисперсной системы понимают ее способность сохранять во времени
– средний размер частиц
– их равномерное распределение в среде
Для дисперсных систем различают два вида устойчивости – кинетическую (седиментационную) и агрегатную.
Кинетическая (седиментационная) устойчивость характеризует способность частиц дисперсной фазы находиться во взвешенном состоянии и не оседать под действием сил тяжести.
Агрегатная устойчивость характеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять неизменными свои размеры.
Коллоидные растворы по устойчивости занимают промежуточное положение между грубодисперсными системами и истинными растворами. Коллоидные растворы обычно представляют собой седиментационно устойчивые системы, что обусловлено
1. малыми размерами частиц
2. их интенсивным броуновским движением
К факторам агрегативной устойчивости относится следующее:
1. наличие электрического заряда частиц препятствует их слипанию
2. способность к сольватации противоионов диффузного слоя; образующиеся на поверхности частиц защитные слои из сольватированных противоионов также препятствуют их слипанию
3. адсорбция на поверхности веществ ПАВ (поверхностно-активных веществ); вокруг “гидрофильных головок” ПАВ ориентируются диполи воды, в результате формируется адсорбционно-сольватный слой, препятствующий слипанию. Данное явление называется – “коллоидная защита”
4. вязкость среды: чем больше вязкость, тем меньше скорость частиц, меньше возможности для столкновения и седиментации.
Нарушение устойчивости дисперсных систем приводит к возникновению коагуляции, а в дальнейшем к седиментации частиц дисперсной фазы.
Коагуляцией называется процесс слипания коллоидных частиц с образованием более крупных агрегатов из-за потери коллоидным раствором агрегативной устойчивости.
Коагуляцию могут вызвать различные внешние воздействия:
1. добавление небольших количеств электролита
2. концентрирование коллоидного раствора
3. изменение температуры
4. действие ультразвука
5. действие электромагнитного поля
6. встряхивание, перемешивание и т.д.
В биологических системах наибольшее практическое значение имеет коагуляция электролитами, т.к. коллоидные растворы клеток и биологических жидкостей находятся в соприкосновении с электролитами.
Для каждого электролита необходима своя минимальная концентрация, называемая порогом коагуляции или пороговой концентрацией (СПК).
Величина, обратная порогу коагуляции, называется коагулирующей способностью:

Существуют следующие правила коагуляции электролитами:
1. Коагуляцию вызывают ионы, которые имеют знак заряда, противоположный знаку заряда гранул. Коагуляцию положительно заряженных золей вызывают анионы, отрицательно заряженных – катионы.
2. Коагулирующее действие ионов тем сильнее, чем выше заряд иона – коагулянта (правило Шульце-Гарди)
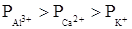 лиотропный ряд катионов
лиотропный ряд катионов
 лиотропный ряд анионов
лиотропный ряд анионов
3. Для ионов одного заряда коагулирующая способность зависит от радиуса сольватированного иона: чем больше радиус, тем меньше коагулирующая способность.
Следовательно, для катионов щелочных металлов можно записать следующий лиотропный ряд:

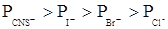
В механизмах коагуляции роль электролитов заключается в том, что:
1. может происходить уменьшение заряда поверхности твердой фазы (заряда поверхности ядер), т.е. за счет снижения межфазного (электротермодинамического) потенциала E.
2. может происходить уменьшение толщины диффузного слоя при неизменном заряде поверхности ядер.
В связи с этим различают следующие теории коагуляции:
1. адсорбционная (химическая) теория Фрейндлиха
2. физическая теория коагуляции ДЛФО (Б. В. Дерягина, Л.Д. Ландау, Э. Фервея, Дж. Т. Овербека)
1. Согласно теории Фрейндлиха коагуляция происходит под действием электролита, который химически взаимодействует с потенциалопределяющими ионами, связывая их в прочное соединение (например, переводя в осадок).
Так, при добавлении к положительно заряженному золю иодида серебра AgI сульфида калия K2S между коагулирующими анионами S 2- и потенциалопределяющими катионами Ag + происходит реакция: 2Ag + + S 2- → Ag2S↓. В результате величина межфазного потенциала падает, число противоионов, необходимых для компенсации заряда ядер также уменьшается, а, следовательно, уменьшаются и гидратные оболочки вокруг ионов, что и приводит к слипанию частиц, т.е. к коагуляции. Кроме того, снижение величины межфазного потенциала влечет и уменьшение ξ-потенциала, т.е. уменьшение заряда частиц, что приводит к падению устойчивости, т.е. к коагуляции.
2. Согласно теории ДЛФО коагуляция наступает под действием электролита, который химически не взаимодействует с ПОИ и не изменяет заряд ядра.
В этом случае коагулирующее действие проявляют те ионы добавленного электролита, которые являются противоионами для данных мицелл.
Повышение концентрации электролита приводит к уменьшению диффузного слоя. Межфазный потенциал при этом остается неизменным, однако происходит уменьшение ξ-потенциала.
Например: при добавлении нитратов к положительно заряженному золю иодида серебра AgI, мицеллы которого содержат противоионы NO3 –

По мере увеличения концентрации добавляемых ионов NO3 – они способствуют внедрению противоионов из диффузного слоя в слой адсорбционный. Диффузный слой сжимается и может наступить такое состояние, при котором диффузный слой совсем исчезнет и гранула станет электронейтральной, т.е. она будет находиться в изоэлектрическом состоянии.
Изоэлектрическим состоянием называется состояние коллоидных частиц, при котором электрокинетический потенциал (ξ) равен 0 и, которое характеризуется отсутствием направленного движения гранул в электрическом поле.
В агрегативно-устойчивом состоянии коллоидного раствора значение ξ-потенциала колеблется в пределах 50-70 мВ. При уменьшении ξ-потенциала под действием электролита до 25-30 мВ в системе не наблюдается никаких внешних изменений (помутнения или изменения окраски), так как скорость коагуляции очень низкая, вследствие чего эта стадия (I) называется “скрытой” коагуляцией (рис).

рис. Влияние концентрации электролита на скорость коагуляции
Дальнейшее добавление электролита ( > Сnn) сопровождается помутнением раствора и начинается “явная” коагуляция. Вначале скорость коагуляции быстро увеличивается (стадия II), а затем становится постоянной, когда значение ξ-потенциала станет равным 0 и наступит стадия быстрой коагуляции (III).
Коагуляция смесями электролитов
Существуют 3 возможных варианта взаимодействия между электролитами: аддитивное действие, антагонизм и синергизм.
Аддитивность – это суммирование коагулирующего действия ионов, вызывающих коагуляцию.
Аддитивное действие наблюдается в тех случаях, когда электролиты, содержащие коагулирующие ионы, химически не взаимодействуют между собой.
Например, смесь солей KCl, NaNO3 проявляет аддитивное действие по отношению и к отрицательно заряженным золям (коагуляцию вызывают K + , Na + ), и к положительно заряженным золям (коагуляцию вызывают Cl – , NO3 – ).
Антагонизм – это ослабление коагулирующего действия одного электролита в присутствии другого.
Антагонизм проявляется в том случае, когда в результате химической реакции между электролитами коагулирующие ионы связываются в нерастворимые соединения (выпадают в осадок) или в прочный комплекс, который не обладает коагулирующей способностью.
Например, коагулирующее действие катионов Pb 2+ по отношению к отрицательным золям ослабляется в присутствии NaCl, т.к. протекает реакция
Pb 2+ + 2Cl – = PbCl2↓
Синергизм – это усиление коагулирующего действия одного электролита в присутствии другого.
Синергизм возможен, если между электролитами происходит химическое взаимодействие, в результате которого образуется многозарядный ион.
Например, коагулирующее действие FeCl3 и KCNS по отношению к положительным золям (коагулирующие ионы Cl – , CNS – ) усиливается, т.к. происходит реакция
и образуются ионы [Fe(CNS)6] 3- , обладающие высокой коагулирующей способностью.
Используя электролиты в медицине, необходимо учитывать возможность коагуляции в биологических средах, так например при введении различных лекарственных веществ в организм в виде инъекций следует знать, не являются ли эти вещества синергистами, чтобы избежать возможной коагуляции.
Гетерокоагуляцией называется коагуляция коллоидных растворов, содержащих разнородные частицы, отличающиеся по химической природе, знаку или величине заряда.
Частным случаем гетерокоагуляции является взаимная коагуляция – слипание разноименно заряженных коллоидных частиц. При этом коагуляция происходит тем полнее, чем полнее нейтрализуются заряды коллоидных частиц (заряды гранул).
Пептизацией называют процесс, обратный коагуляции – процесс превращения осадка, образовавшегося в результате коагуляции, в устойчивый коллоидный раствор.
Пептизацию на практике осуществляют двумя способами:
1. Промывание осадка чистым растворителем (дисперсионной средой), что приводит к вымыванию ионов, вызывающих коагуляцию.
2. Добавление специального электролита – пептизатора, ионы которого, адсорбируясь на поверхности частиц, восстанавливают ионные атмосферы вокруг частиц.
Условия, необходимые для проведения пептизации:
1. К пептизации способны только свежеполученные осадки, т.к. длительное хранение приводит к срастанию частиц осадка, к его постепенному уплотнению и вытеснению из его структуры жидкой фазы.
2. Добавление небольших количеств электролита (иначе наступает коагуляция)
3. Перемешивание раствора
Коллоидной защитой называется повышение агрегативной устойчивости лиофобных золей при добавлении к ним ВМС.
Механизм защитного действия заключается в том, что в водных коллоидных растворах дифильные молекулы ВМС, адсорбируясь на поверхности коллоидных частиц, ориентируются таким образом, что их гидрофобные участки обращены к частицам дисперсной фазы, а гидрофильные – к воде. В результате поверхность частиц становится лиофильной и покрывается дополнительной сольватной оболочкой.

По отношению к водным коллоидным растворам защитным действие обладают хорошо растворимые в воде белки. Так, белки крови препятствуют выпадению в осадок и выделению на стенках кровеносных сосудов холестерина и солей кальция.
Коллоидная защита используется при получении устойчивых лиофобных золей, применяемых в качестве лекарственных препаратов. Например, колларгол и протаргол содержат высокодисперсное металлическое серебро, защищенное высокомолекулярными соединениями.
77.243.189.108 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Физико-химические помутнения вина
Они являются наиболее распространенными, сложными по составу и разнообразными по причинам, которые их вызывают. В соответствии с причинами они подразделяются на три основные группы: кристаллические, коллоидные и металлокассовые.
Кристаллические помутнения связаны с выпадением в осадок труднорастворимых солей винной кислоты на основе калия и кальция, иногда с участием солей щавелевой и слизевой кислот.
Эти помутнения возникают при понижении температуры, после спиртования, удаления защитных коллоидов, повышения величины рН, увеличения количества кальция, например за счет обработки вина бентонитом и других причин.
Процесс кристаллизации протекает в два этапа: сначала появляются зародыши кристаллов — центры кристаллизации, затем происходит рост кристаллов за счет свободных валентных связей, образующихся на углах и ребрах кристаллов. У молодых вин, насыщенных тартратами, благодаря взвешенным частицам мути и обилию коллоидов кристаллизация солей винной кислоты происходит очень медленно.
Поэтому, полезны оклейка и фильтрация молодых вин, способствующие выпадению кристаллических осадков. Калиевые соли дают в осадке продолговатые кристаллы с острыми углами, кальциевые — крупные кристаллы с гладкой поверхностью.
При излишнем введении в сусло или вино карбоната кальция наблюдается помутнение, связанное с образованием двойной соли винной и яблочной кислот. Кристаллы этой соли имеют ежиковидную или пучкообразную форму.
Для испытания виноматериалов на склонность к кристаллическим помутнениям к 10 мл вина добавляют несколько кристаллов винного камня и выдерживают в холодильнике 1—2 суток при температуре минус 3—4°С для столовых и минус 7—8°С для крепких вин. Последующий анализ полученных осадков по специальной методике позволяет определить устойчивость вина к кристаллическим помутнениям.
Коллоидные помутнения возникают в результате коагуляции находящихся в коллоидном состоянии веществ или вследствие физико-химических реакций составных веществ вина, переходящих из ионного в неустойчивое коллоидное состояние.
К коллоидным помутнениям относятся белковые, полифенольные, полисахаридные, липидные и комплексные (белково-полисахаридно-полифенольные). Они делятся на две группы по температурному фактору воздействия: необратимые и обратимые. Так, при нагревании вина происходят необратимая коагуляция и осаждение белков и других коллоидов. Обратимые помутнения возникают при охлаждении вина. Если помутневшее на холоде вино нагреть, коллоидная муть исчезает.
Механизм коллоидных помутнений объясняется электрической заряженностью коллоидных частиц и электрохимическими процессами, происходящими в коллоидных и коллоидно-ионных растворах.
Электрический заряд образуется в результате адсорбции на поверхности коллоидных частиц ионов или анионов, сообщающих отрицательный заряд, или катионов, которые сообщают положительный заряд. Из различных ионов электрозаряженность коллоидных частиц вина чаще всего определяется катионами Н+ и анионами ОН-, которые сообщают им соответственно положительный и отрицательный заряды.
В связи с этим при нормальной величине рН положительный заряд имеют некоагулированные протеины (белки) вина, оклеивающие вещества органического происхождения (желатин, рыбный клей), целлюлоза. Отрицательно заряжены таннин, пектиновые вещества, бентонит, диатомит, свернувшиеся от нагревания и коагулированные таннином протеины, берлинская лазурь, наконец, все мелкие, суспендированные в вине взвешенные частицы.
Переход коллоидов из золя (прозрачный раствор) в гель (мутный раствор) и составляет суть коллоидных помутнений. Чтобы избавиться от этого состояния коллоидов, их необходимо подвергнуть коагуляции и седиментации (выпадению в осадок).
Для коагуляции гидрофильных и гидрофобных коллоидных частиц необходимо снять электрическую заряженность и обеспечить дегидратацию коллоидов. Дегидратации способствуют нагревание, внесение спирта или таннина, наличие солей. Снятие электрической заряженности происходит при соприкосновении с противоположно заряженными частицами. На этом основаны почти все виды оклейки и фильтрации соков и вин, взаимное осаждение противоположно заряженных коллоидов, происходящее во время естественной длительной выдержки помутневших вин.
Коллоидные помутнения являются наиболее частыми (составляют более 50% всех помутнений вин) и трудноустранимыми. Их возникновению способствуют повышенное содержание протеинов (более 15 мг/л), фенольных веществ, полисахаридов, липидов, использование недостаточно зрелого винограда, последних прессовых фракций сусла, высокое для белковых и, наоборот, низкое для фенольных помутнений значение рН и температуры.
Происхождение обратимых и необратимых коллоидных помутнений, их прогнозирование устанавливают по специальной методике, основанной на температурных перепадах (от минус 3 до плюс 75 °С), выделении и анализе получаемых осадков.
Металлокассовые помутнения вызываются наличием в вине соединений тяжелых металлов — железа, меди, олова и др., вступающих во взаимодействие с другими компонентами — фенольными веществами, фосфатами, сульфидами, белками, в результате чего образуются помутнения коллоидного характера.
В винах наиболее часто встречаются железный, медный и белый кассы.
Железный касс, называемый иногда почернением вина, встречается чаще всего. Действительно, при содержании трехвалентного железа более 12—15 мг/л и свободном доступе воздуха вино чернеет, приобретая неприятный железистый привкус.
При этом железо взаимодействует с фенольными веществами, интенсивно окисляя все ценные и трудноокисляемые ароматические и экстрактивные вещества вина. Источником железа служат металлические незащищенные поверхности сборочных бункеров, емкостей и технологического оборудования. Железный касс исчезает в бескислородных условиях.
Белый касс вызывается взаимодействием железа с фосфатами. Он характеризуется появлением в вине сизо-белесых оттенков, образованием аморфных светлых осадков, часто сизовато-черного цвета. Флокуляции железофосфатных соединений способствуют катионы калия, кальция, магния.
Медный касс при наличии меди 0,15 г/л и выше возникает (в противоположность железному кассу) в анаэробных условиях и исчезает в присутствии воздуха.
Склонность вин к металлокассовым помутнениям выявляют путем прибавления к 100 мл вина 5 капель 3%-ного пероксида водорода и выдержки в течение 2 суток. Если появляется осадок бурого цвета, не растворяющийся в растворе гидросульфита натрия, то вино нестойко к металлокассовым помутнениям.
Источники:
http://wine.historic.ru/books/item/f00/s00/z0000015/st155.shtml
http://studopedia.ru/4_16110_elektrokineticheskie-yavleniya.html
http://vinocenter.ru/fiziko-ximicheskie-pomutneniya-vina.html





