Автолиз дрожжей, неферментативные окислительно-восстановительные процессы – Теория окислительно-восстановительных процессов
Автолиз дрожжей, неферментативные окислительно-восстановительные процессы – Теория окислительно-восстановительных процессов
Окислительно –восстановительные процессы.
Окисление спиртов, прежде всего этилового, приводит к образованию альдегидов – уксусного, изобутилового, изоамилового, бензилового и др. Источником образования альдегидов может быть также окислительное дезаминирование и последующее декарбоксилирование аминокислот. Дальнейшее окисление альдегидов приводит к образованию кислот,которые затем вовлекаются в последующие реакции.
2.Реакция меланоидинообразования.
Промежуточными продуктами являются алифатические альдегиды, летучие кислоты, альдегиды фуранового ряда и др. Их количество повышается по мере увеличения перегонки. Реакция меланоидинообразования проходит более интенсивно в присутствии дрожжей, что влечет накопление больших количеств летучих кислот при дистилляции вина с дрожжевым осадком. Присутствующие в вине пентозы, метилпентозы, гексозы обеспечивают появление фурфурола, метилфурфурола, оксиметилфурфурола, а также фурилкарбинола, фурилакролеина, фуранкарбоновой кислоты.
Реакции этерификации.
В наибольших количествах из эфиров образуется уксусноэтиловый эфир, меньше накапливается метилацетата, изобутилацетата, изоамилацетата, этилсукцината, диэтилмалата, этилсалицилата. Большему новообразованию эфиров в кубе способствует более низкое значение pH вина. Добавление дрожжевых осадков резко увеличивает прирост эфиров в дистилляте,т.к. из дрожжей в вино переходят высшие спирты. Помимо спиртов алифатического ряда в дистилляте увеличивается содержание терпеновых спиртов. В винах эти спирты содержатся в небольшом количестве. С увеличением продолжительности перегонки количество высших спиртов увеличивается, как правило, их больше в последних пробах дистиллята. Новообразовавшиеся спирты также вступают в реакцию этерификации.
Гидролитические процессы, реакции дегидратации, декарбоксилирование.
При распаде углеводов и сложных эфиров, ацеталей, дегидратации пентоз и гексоз, образовании циклических альдегидов образуются продукты,которые при перегонке образуют летучие вещества.
На появление новых продуктов при перегонке также оказывает влияние материал перегонного аппарата.
Билет №22
1. Интенсификация приготовления мадеры и хереса. Технологическое оборудование, используемое для этой цели.
Мадера : Определяющими факторами, под воздействием которых формируются характерные типичные свойства Мадеры являются концентрации фенольных и других экстрактивных веществ, высокая температура и кислород. С целью интенсификации процесса мадеризации, обусловленной усилением взаимодействия компонентов вина, целесообразно осуществлять контакт глубинных слоев вина с кислородной «подушкой» путем перемешивания. С увеличением частоты перемешивания, особенно в начальный период процесса, мадеризация ускоряется, густота букета и типичность вкуса усиливаются, но при ежедневном перемешивании в течение всего срока мадеризации наблюдается некоторая утрата тонкости вкуса. Поэтому в большинстве случаев выбор режимов мадеризации, включая частоту перемешивания, способ и количество вводимого кислорода, уровень температуры проводят с учетом конкретных условий производства. Кислородный режим процесса мадеризации оказывает большое влияние на концентрацию в вине альдегидов, участвующих в сложении типичной Мадеры: нагревание вина в герметизированной таре с доступом кислорода (277,5 мг/дм3) приводит к увеличению количества альдегидов на 218 %. С повышением температуры ускоряется поглощение вином кислорода и усиливаются окислительные процессы, сопровождающиеся накоплением альдегидов и эфиров. При этом технологическое значение имеет температура выше 25 °С, ниже которой мадеризация не проявляется. Добавление в вино дрожжевых осадков или автолизатов дрожжей позволяет готовить типичные зрелые вина, отличающиеся особой полнотой и округлостью вкуса. Наличие в вине сернистой кислоты, а также катионов железа и меди способствует ускорению процесса мадеризации, а в случае с SO2 и получению более тонкой Мадеры С целью интенсификации массообмена между вином и кислородом разработан ряд способов. Такая интенсификация достигается диспергированием нагретого до 80 – 85°С виноматериала в пространстве, заполненном воздухом или кислородом. Виноматериал непрерывно циркулирует в замкнутом контуре: Реактор – насос – теплообменник – распылитель. Способ предусматривает добавление в виноматериал при необходимости экстрактов древесины дуба и автолизатов дрожжей. При условии подачи в вино 10мг/дм³·ч кислорода процесс мадеризации при 80°С по этому способу завершается за 50-60 часов. Разработан также способ воздействия на вино наряду с теплом переменного и постоянного тока. Переменный электрический ток оказывает в основном тепловое воздействие на вино, и используется для его нагрева и поддержания заданной при мадеризации температуры. Постоянный ток помимо теплового эффекта вызывает сильное окисления вина за счёт атомарного кислорода, выделяемого при электролизе воды. Херес: При выдержке вина под хересной плёнкой в аэробных условиях в процессе её жизнедеятельности происходят значительные изменения химического состава вин. Важную роль в этих изменениях играют окислительно-восстановительные, а также автолитические процессы. Хересные дрожжи интенсивно поглощают азотистые вещества, они способны также ассимилировать азот из воздуха. Хорошим источником азота для них являются аминокислоты. При их достаточном количестве в вине повышается активность обмена веществ дрожжей, в частности использование этилового спирта, глицерина, уксусной кислоты. Поскольку аминокислоты являются источниками высших спиртов, альдегидов и других соединений, их превращения в процессе выдержки вина имеют важное значение в формировании аромата и вкуса хереса. Для интенсификации процессов целесообразно использовать настойные резервуары, экстракторы. Для брожения сусла на мезге возможно использовать установки применяемые для получения красных виноматериалов.
2. Классификация помутнений вин. Характеристика помутнений и причин их вызывающих
Получение стабильных вин, не склонных к различного рода помутнениям, является одной из основных задач виноделов.
Вино, представляющее собой многокомпонентную среду, вследствие нарушения равновесия в системе, может помутнеет и потерять свой товарный вид.
Склонность вина к помутнениям доказывает, что оно не достигло устойчивого равновесия и для придания ему стабильности требуется дополнительная технологическая обработка.
Помутнение вин возникают: после переливок, вследствие химических и физико-химических процессов, растворенных в вине веществ; в результате изменения температурных условий; уровня окислительно-восстановительного потенциала и степени насыщенности вина кислородом.
Способ обработки зависит от характера и вида помутнения.
Помутнения вин подразделяют на 3 группы: микробиологические, физико-химические и биохимические, которые в свою очередь подразделяются на более специфические.
1) Биологические помутнения – вызываются микроорганизмами ( дрожжами, бактериями, плесенями)
При биологических помутнениях помимо внешнего вида значительно изменяется вкус и букет вина.
Наиболее склонны к такого рода помутнениям сухие и полусладкие вина, некоторым бактериальным помутнениям могут подвергаться десертные и крепкие вина.
2) Биохимические помутнения – (оксидазные кассы) вызываются окислительными ферментами, действующими на фенольные вещества под действием кислорода воздуха.
При биохимических помутнениях наблюдается побурение вина, выпадение темно бурого осадка. Склонность к оксидазному кассу большей частью наблюдается в винах, полученных из пораженного гнилью или заплесневевшего винограда.
3) Физико-химические помутнения разделяются на кристаллические, коллоидные и металлические помутнения:
– кристаллические помутнения яв. следствием солей органических кислот, и обусловлены выпадением в осадок солей виннокислого калия и виннокислого кальция.
– металлические вызываются присутствием в вине тяжелых металлов, способствующих появлению кассов медного, железного и т.д.
-коллоидные возникают вследствие коагуляции находящиеся в коллоидном состояние веществ или в результате внутренних реакций в период длительного хранения вина с образованием неустойчивых веществ.
Коллоидные помутнения, которые вызываются температурным фактором можно подразделить на обратимые и необратимые. Обратимые возникают при охлаждении вина. Если помутневшее вино нагреть, то муть исчезнет.
Необратимые коллоидные помутнения возникают при аэрации, которая приводит к окислительным преобразованиям одних компонентов или при нагревании, обусловливающем коагуляцию и осаждения других.
3. Плодовые игристые и газированные вина. Особенности их технологии.
Плодово-ягодным вином называется продукт, произведенный путем спиртового брожения сусла или мезги свежих плодов и ягод с добавлением сахара, а также спирта (кроме вин, содержащих избыток углекислого газа, столовых и некрепленых). Сусло — сок, поставленный на брожение. Основное сырье для производства плодовых вин — следующие свежие плоды: абрикосы, айва, алыча мелкоплодная и крупноплодная, барбарис, брусника, вишня, голубика, груша, ежевика, земляника, кизил, клюква, крыжовник, малина, облепиха, персик, рябина обыкновенная, рябина черноплодная, слива, смородина белая, черная и красная, черешня, яблоки. Столовые некрепленые вина и вина, насыщенные углекислым газом, отличаются от других плодово-ягодных вин тем, что требуемую крепость в них получают за счет брожения (естественного наброда).
Основные технологические операции виноделия. Плоды и ягоды моют, кроме малины и ежевики, удаляют непригодные для переработки экземпляры, затем измельчают и прессуют для отжима сока. Для увеличения выхода сока мезгу подбраживают, подвергают предварительной обработке пектолитическими ферментными препаратами или нагревают до 70—85 °С, а затем прессуют.
Подбраживание мезги наиболее целесообразно. Для этого применяют чистые культуры винных дрожжей, которые более эффективно влияют на винное брожение. Мезгу подбраживают до отделения сока в течение 1—2 сут, сливают сок-самотек, затем из мезги отжимают сок. Если сырье имеет излишнюю кислотность, то к выжимкам добавляют определенное количество воды по предварительным расчетам и отжимают сок, который называется соком второго отжима. Полученные партии сока объединяют и ставят на брожение. Воду для мойки сырья, разбавления сока, снижения кислотности или приготовления сахарного сиропа используют только питьевую, без содержания тяжелых металлов, особенно солей железа. Если в воде имеются соли железа, то они с дубильными веществами сока дадут синее или сине-зеленое окрашивание, что ухудшает цвет вина.
Если используют сок, полученный без подбраживания мезги, то к нему добавляют разводку чистой культуры винных дрожжей — 2—4% количества сока. Брожение соков ведут при температуре 18—22 “С в закрытых емкостях с установкой бродильного шпунта (гидравлический клапан). Если температура снизится до 15 °С, брожение замедляется, а при температуре выше 25 °С возможно маслянокислое брожение, ухудшающее качество вина. Сбраживание сока без бродильного шпунта, т. е. при доступе воздуха, приводит к началу уксусного скисания. Уксуснокислые бактерии окисляют спирт в уксусную кислоту, которая замедляет спиртовое брожение и ухудшает качество вина.
1. Плодовые игристые вина.Насыщение углекислым газом игристых вин происходит за счет естественного брожения в специальных герметических резервуарах или непосредственно в бутылках с последующим удалением осадка. Содержание спирта в игристых винах должно быть 11,5% об., а сахара 5 г/100 мл. Давление углекислого газа в бутылках с игристым вином должно быть не менее 0,15 МПа.
2. Плодовые шипучие вина (газированные).В отличие от игристых вин получают путем сбраживания подслащенного сусла и искусственного насыщения углекислым газом до необходимых пределов. Содержание спирта 10—11% об., сахара 7—10 г/100 мл. Давление углекислого газа в бутылках с шипучим вином не менее 0,1 МПа. Перенасыщение вина диоксидом углерода осуществляется с помощью:
– сатураторов периодического и непрерывного действия;
– акратофор методом барботажной абсорбции;
– принудительной диффузии CO2 из надвинного пространства через поверхность вина;
– жидкого CO2, дозируемом в поток вина при повышенном давлении;
– растворения CO2 в вине при давлении 4000-5000 кПА.
Окислительно-восстановительные процессы
Окислительно-восстановительные процессы (ОВП) играют важную роль в жизнедеятельности организма, поскольку именно в процессах окисления происходит выделение и запас энергии, а восстановительные процессы связаны с биосинтезом белков, нуклеиновых кислот, полисахаридов в организме. Окислительно-восстановительные реакции – это реакции, идущие с переносом электронов и изменением степени окисления элементов.
ОВП состоят из двух одновременно протекающих и противоположно направленных процессов – окисления и восстановления. Окисление – это процесс отдачи электронов, в ходе которого происходит увеличение степени окисления элементов. Восстановление – это процесс присоединения электронов, в ходе которого происходит уменьшение степени окисления элементов. Окислитель – это вещество, атом которого принимает электроны, тем самым уменьшая степень окисления. Восстановитель – это вещество, атом которого отдает электроны, тем самым увеличивая степень окисления. ОВП подразделяются на три типа.
1. Межмолекулярные, в которых окислитель и восстановитель находятся в разных молекулах, например:
окислитель – Mn +7 , восстановитель – N +3 .
2. Внутримолекулярные, в которых окислитель и восстановитель находятся в одной молекуле, но являются разными элементами, например:
2KCl +5 O3 -2 = 2KCl -1 + 3O4 0
окислитель – Cl +5 , восстановитель – O -2 .
3. Диспропорционирования (самоокисления – самовосстановления), в которых окислителем является один и тот же элемент в одной и той же степени окисления, например:
3Cl2 0 + 6KOH = 5КСl -1 + KCl +5 O3 + 3H2O
окислитель – Cl 0 , восстановитель – Cl 0 .
В ходе окислительно-восстановительных процессов между частями системы происходит перераспределение зарядов. Возникающая разность зарядов между частями системы носит название потенциал. Существует несколько видов потенциалов, связанных с прохождением различных процессов.
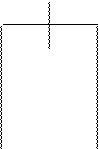
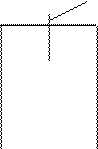
Одним из них является электродный потенциал, который возникает в том случае, когда пластинку металла погружают в раствор его соли (например, пластинку цинка в раствор сульфата цинка). При этом возможно прохождение двух процессов, которые определяются активностью металла и концентраций его катиона в растворе (рис.1).
 Ме Ме
Ме Ме
 + _ + _ _
+ _ + _ _

 Ме n+ + _ + Ме n+ _ + _
Ме n+ + _ + Ме n+ _ + _
 + _ + _ + _
+ _ + _ + _


рис. 1 Виды электродных процессов
Первый процесс происходит в том случае, когда активность металла высока, а концентрация его катиона невелика. В этом случае (см. рис. 1) ионы металла, находящиеся в узлах кристаллической решетки металла, вследствие гидратации будут переходить в раствор, заряжая его положительно; электроны, входящие в состав «электронного газа» (особенности металлической связи) остаются на куске металла, придавая ему отрицательный заряд.
В случае низкой активности металла и высокой концентрации его катиона процесс может идти в другом направлении (см. рис. 2). Катионы металла могут перейти на пластинку, достраивая кристаллическую решетку металла и придавая ей положительный заряд; анионы соли остаются в растворе, заряжая его отрицательно. В обоих процессах между пластинкой металла и раствором его соли возникает разность зарядов, называемая электродным потенциалом Е. Независимо от механизма возникновения электродного потенциала, он определяется окислительно-восстановительным процессом, а его величина – уравнением Нернста:


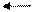
 Me Me n+ + ne –
Me Me n+ + ne –
 Zn Zn 2+ + 2e –
Zn Zn 2+ + 2e –
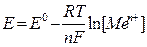
где: Е – потенциал системы,
Е 0 – стандартный потенциал системы, т.е. потенциал, определенный в стандартных условиях (Т=292 К, р=1 атм, [Red] = [Ох] = 1 моль/л)
Т – абсолютная температура,
n – число электронов, участвующих в процессе,
R = 8,31 Дж/моль * К,
F = 96500 Кл/моль
[Ме п+ ] – равновесная концентрация соли данного металла.
Подставляя постоянные при 25 0 С, получим:

По величине стандартного электродного потенциала все металлы выстраиваются в электрохимический ряд напряжений.
Одним из основных является окислительно-восстановительный потенциал. Его возникновение связано с обратимостью окислительно-восстановительных процессов. Одно и то же вещество в зависимости от условий может находиться либо в окисленной (Oх), либо восстановленной (Red) форме. Между этими двумя формами идут процессы взаимного перехода, сопровождающиеся изменением заряда системы. Процесс взаимного перехода идет до тех пор, пока между двумя формами не установится равновесие:

 Red Ox + ne
Red Ox + ne

 Fe 2+ Fe 3+ + e
Fe 2+ Fe 3+ + e
После установления равновесия в системе возникает избыточный заряд, называемый окислительно-восстановительным или редокс-потенциалом. Его величина определяется уравнением Нернста:
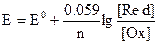
где: Е – потенциал системы,
Е 0 – стандартный потенциал системы, т.е. потенциал, определенный в стандартных условиях (Т=292 К, р=1 атм, [Red] = [Ох] = 1 моль/л)
[Red], [Ох] – равновесные концентрации восстановленной и окисленной форм.
Любой окислительно-восстановительный процесс можно представить как взаимодействие двух редокс-систем – системы окислителя и системы восстановителя. Направление ОВП будет определяться величинами редокспотенциалов систем.
При этом можно выделить следующие закономерности:
1. Одна и та же редокс-система может являться как окислителем, так и восстановителем – это зависит от соотношения величин потенциалов;
2. Системы с более отрицательным потенциалом будут восстанавливать системы с более положительным потенциалом;
3. После прохождения ОВП потенциалы редокс-систем выравниваются.
Возникновение разности зарядов между частями системы может быть и не связано с прохождением ОВП. Так, в ходе процесса диффузии между частями раствора, вследствие различной подвижности ионов, возникает разность зарядов, называемая диффузным потенциалом. Диффузный потенциал существует недолго и исчезает по окончании процесса диффузии.
Если два раствора разделить полупроницаемой мембраной, то на сторонах мембраны возникает разность зарядов, называемая мембранным потенциалом. Возникновение мембранного потенциала связано с тем, что вследствие различного размера ионов они могут проходить или не проходить через мембрану.
В живых организмах, вследствие наличия многочисленных мембран, направленного транспорта веществ и прохождения различных ОВП между его частями, возникает разность зарядов, называемая биопотенциалами. По своей природе биопотенциалы могут быть диффузными, мембранными и редокспотенциалами. Биопотенциалы играют важнейшую роль в направленном транспорте веществ, работе мембранных систем, процессах биосинтеза, выделение и запасание энергии. Выделение и запасание организмом энергии тесно связано с процессами окисления и восстановления.
77.243.189.108 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
“Теория окислительно-восстановительных процессов.” Теоретический материал ( 11 класс)
Добавляйте авторские материалы и получите призы от Инфоурок
Еженедельный призовой фонд 100 000 Р


1) Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества, называют ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫМИ РЕАКЦИЯМИ.
В окислительно-восстановительных реакциях электроны не уходят из сферы реакции, а передаются от одного элемента к другому.
Вещества, участвующие в окислительно-восстановительных реакциях, и у которых изменились степени окисления, являются либо окислителями, либо восстановителями.
ОКИСЛИТЕЛИ – это атомы, ионы или молекулы, которые принимают электроны.
ВОССТАНОВИТЕЛИ – это атомы, ионы или молекулы, которые отдают электроны.
2)Типичные восстановители и окислители.
1) вещества (оксиды, кислоты, соли) с максимально положительной степенью окисления входящего в них элемента.
2) Самые активные неметаллы – фтор, кислород, озон
1) B се металлы (они могут только отдавать электроны);
2) B ещества с минимально возможной (отрицательной) степенью окисления неметалла.
Например: водородные соединения – РН3, HI , HBr , H 2 S ;
соли – KI, NaBr, K 2 S .
Все остальные вещества в зависимости от условий могут быть как окислителями, так и восстановителями: например, Н2О2, KNO 2, SO 2, простые вещества-неметаллы (кроме фтора и кислорода) могут как принимать, так и отдавать электроны.
3) Процессы окисления и восстановления
В окислительно-восстановительной реакции различают два процесса:
окисление – процесс, в котором восстановитель отдает электроны;
восстановление – процесс, в котором окислитель принимает электроны.
Запомните: окислитель восстанавливается! восстановитель окисляется!
4) Что такое электронный баланс?
Уравнения окислительно-восстановительных реакций составляют, пользуясь методом ЭЛЕКТРОННОГО БАЛАНСА: число отданных и принятых электронов должно быть одинаково.
Азотная кислота – типичный окислитель. Она восстанавливается до N +4 O 2, углерод в этой реакции будет восстановителем , окислится до С +4 О2.
Составляем электронный баланс:
N +5 + 1е N +4 4 – окислитель
C 0 – 4 е С +4 1 – восстановитель
Таким образом, в уравнении реакции перед оксидом азота и азотной кислотой должен стоять коэффициент 4, а перед углеродом и углекислым газом – 1. Остаётся уравнять воду.
Главные схемы окислительно-восстановительных переходов



( MnO 2 ↓ бурый осадок)

+
 восстановители
восстановители
в нейтральной среде
в щелочной среде
Во что переходят восстановители в реакциях с KMnO 4 или K 2 Cr 2 O 7?
а) S 2- , I – , Br – , Cl – переходят в Э 0
в) N +3 , S +4 , P +3 , и т.п. в высшую степень окисления
(соль или кислота)
Разложение нитратов (по ряду активности металлов!).
1. Металлы левее магния кроме лития.
до меди включительно+ литий
*оксид металла в наиболее устойчивой степени окисления.
→ чем активнее металл и чем более разбавленная кислота →
– не реагируют с азотной кислотой Au , Pt , Pd .
– пассивация Al , Cr , Fe*
*Пассивация – металлы не реагируют с конц. кислотой без нагревания из-за наличия плотной оксидной плёнки
** Магний и кальций с кислотой любой концентрации восстанавливают её до N 2 O !
– не реаг Au , Pt , Pd .
Разбавленная – ведет себя как обычная минеральная кислота!
(пассивация Al , Cr , Fe )**
металлы в ряду активности до Н – Н2 + сульфат металла*.
металлы после Н – не реагируют.
активные металлы и цинк – сульфат металла
Концентрированная кислота + неметаллы
SO 2 ↑ + кислота или оксид неметалла (в макс. степени окисления)
* сульфат металла В НАИМЕНЬШЕЙ степени окисления
**Пассивация – металлы не реагируют с конц. кислотой без нагревания из-за наличия плотной оксидной плёнки.
*** Сероводород получается при взаимодействии щелочных металлов.
Вещества с двойственной природой:
+ восстановитель Н 2 О или ОН –
Нитриты щелочных металлов и аммония:
Реакции диспропорционирования – реакции, в которых один и тот же элемент и отдает и принимает электроны.
Например, в реакции: Cl 2 + KOH KCl -1 + KCl +5 O 3 + H 2 O – простое вещество хлор Cl 2 и принимает электроны, переходя в -1 , и отдает, переходя в устойчивую степень окисления +5
Диспропорционирование неметаллов – серы, фосфора, галогенов (кроме фтора)
Сера + щёлочь 2 соли, сульфид и сульфит металла (реакция идёт при кипячении)
Фосфор + щелочь фосфин РН 3 и соль ГИПОФОСФИТ КН 2 РО 2 (реакция идёт при кипячении)
Хлор + вода (без нагревания) 2 кислоты, HCl , HClO
Хлор + щелочь (без нагревания) 2 соли, К Cl и К ClO и вода
Cl 2 0 Cl – и Cl +
Бром, йод + вода 2 кислоты, HBr , HBrO 3
Хлор + щелочь (при нагревании) 2 соли, К Cl и К ClO 3 и вода
Бром, йод + щелочь две соли и вода.
Cl 2 0 Cl – и Cl + 5
Br 2 0 Br − и Br +5
Диспропорционирование оксида азота ( IV ) и солей
NO 2 + вода 2 кислоты, азотная и азотистая
NO 2 + щелочь 2 соли, нитрат и нитрит
K 2 SO 3 –( t ) сульфид и сульфат калия
KClO 3 –( t )(без катализатора) 2 соли, хлорид и перхлорат КС lO 4
Cl +5 Cl – и Cl +7



Международные дистанционные олимпиады «Эрудит III»
Доступно для всех учеников
1-11 классов и дошкольников
Рекордно низкий оргвзнос
по разным предметам школьной программы (отдельные задания для дошкольников)
Идёт приём заявок

Теоретический материал содержит как основные химические понятия, такие как ” окислитель”, ” восстановитель”, ” окислительно-восстановительная реакция”, так и вопросы, относящиеся к электролизным процессам и окислительным способностям азотной и серной кислот. Коспект может быть с успехом использован и на уроках химии в 11 классе, и при подготовке учащихся к единому государственному экзамену по химии, сразу по нескольким теоретическим вопросам КИМов. Теоретический материал значительно расширяет и углубляет знания, полученные учащимися при изучении данной темы в 8-9 классах и позволяет ответить на многие сложные вопросы данного раздела химии.
- Глушко Татьяна Алексеевна
- Написать
- 754
- 20.02.2015
Номер материала: 400259
- 20.02.2015
- 1165
- 20.02.2015
- 1622
- 20.02.2015
- 2042
- 20.02.2015
- 3225
- 20.02.2015
- 1586
- 20.02.2015
- 12639
- 20.02.2015
- 1650
Не нашли то что искали?
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение редакции может не совпадать с точкой зрения авторов.
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако редакция сайта готова оказать всяческую поддержку в решении любых вопросов связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Источники:
http://infopedia.su/10xd7b9.html
http://studopedia.ru/4_93117_okislitelno-vosstanovitelnie-protsessi.html
http://infourok.ru/teoriya_okislitelno-vosstanovitelnyh_processov._teoreticheskiy_material__11_klass-400259.htm






